| 제품명 |
|
|||
|---|---|---|---|---|
| 성분 / 함량 | 동일성분 의약품 | |||
| 첨가제 | ||||
| 도핑금지 약물정보 |
|
|||
| 전문 / 일반 |
|
단일 / 복합 | ||
| 제조 / 수입사 | ||||
| 제형 | 투여경로 | |||
| 성상 | ||||
| 허가일 |
|
|||
| 재심사 | ||||
| 대조 / 생동 | ||||
| 급여평가결과 | 비급여, 2020년 제03차 평가결과_리포락셀액(대화제약(주)).pdf 회의자료_리포락셀액(대화제약(주)).pdf | |||
| 급여정보 |
|
|||
| ATC 코드 | ||||
| KPIC 약효분류 |
|
|||
| KPIC 학술 |
팜리뷰
[Special Issue] 암 환자의 퇴원 후 관리, 약학정보원(최은경), 2022-12-30
팜리뷰
항암치료와 구내염, 약학정보원(최선), 2017-06-12
팜리뷰
항암치료와 탈모, 약학정보원(최선), 2017-06-05
팜리뷰
완화치료(palliative care), 약학정보원(남궁형욱), 2017-05-15
팜리뷰
비만과 여성암(2), 약학정보원(최혁재), 2017-03-13
팜리뷰
비만과 여성암(1), 약학정보원(최혁재), 2017-03-06
팜리뷰
항암화학요법 시 부작용 경감을 위한 한방의 병용(2) - 말초신경계 부작용, 약학정보원(송보완), 2017-02-27
팜리뷰
항암화학요법 시 부작용 경감을 위한 한방의 병용(I) - 소화기계 부작용, 약학정보원(송보완), 2017-02-20
|
|||
| 대한약사저널 |
이슈트랜드
암 위험인자로서의 비만, 약학정보원 학술정보센터, 2020-08-10
|
|||
| 제품설명서 | 보 기 ( 2017-10-10 게시 ) | |||
| 의약품안전성 정보(DUR) |
||||
| 포장단위 (식약처 기준) |
|
|||
| 저장방법 | ||||
사용자GNB바
컨텐츠
의약품 상세정보
허가정보 ∙ 복약정보
용법 · 용량
이 약은 28일(4주)를 주기로 3주간 투여 후 1주 휴약한다.
과민반응 예방을 위한 예비 투약은 필요 없다.
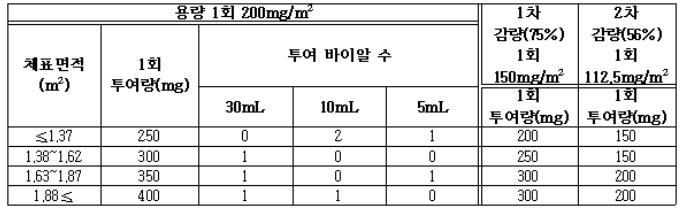
체표면적에 따른 1회 투여량과 용량 조정에 따른 투여량은 아래 표<체표면적에 의한 용량 계산 및 감량 시 투여량>에 따른다.
<체표면적에 의한 용량 계산 및 감량 시 투여량>
주기 시작 시점에는 호중구 수 1,500 cell/mm3 이상, 혈소판 수 100,000 cell/mm3 이상을 만족해야 치료를 시작할 수 있으며 충족되지 않는 경우 투여를 연기한다.
약물 복용 시에는 환자들에게 독성이 나타나는지 주의하여 모니터해야 한다. 이 약의 투여에 의한 독성은 대증 치료, 투약 일시 중단 및 용량 조정에 의해 조절될 수도 있다. 한 번 감량을 경험한 환자는 추후에 증량하지 않는다.
<독성 발생 시 이 약의 용량조절기준>
|
혈액학적 독성 | ||
|
기준* |
발생빈도 |
용량조절 |
|
열성호중구 감소증 |
첫 번째 발현 시 |
1차 감량(75%) |
|
두 번째 발현 시 |
2차 감량(56%) | |
|
세 번째 발현 시 |
치료 영구 중단 | |
|
7일 이상 지속되는 4등급의 호중구감소증 |
첫 번째 발현 시 |
1차 감량(75%) |
|
두 번째 발현 시 |
2차 감량(56%) | |
|
세 번째 발현 시 |
치료 영구 중단 | |
|
4등급 혈소판감소증 |
첫 번째 발현 시 |
1차 감량(75%) |
|
두 번째 발현 시 |
2차 감량(56%) | |
|
세 번째 발현 시 |
치료 영구 중단 | |
|
임상적으로 의미있는 출혈을 동반한 3등급 혈소판감소증 |
첫 번째 발현 시 |
1차 감량(75%) |
|
두 번째 발현 시 |
2차 감량(56%) | |
|
세 번째 발현 시 |
치료 영구 중단 | |
|
비혈액학적 독성 | ||
|
3등급 이상 감각신경병증 |
첫 번째 발현 시 |
치료 영구 중단 |
|
기타 비혈액학적 독성 | ||
|
1등급 이상반응 |
모든 경우 |
투여용량 유지 |
|
2등급 이상반응 |
첫 번째 발현 시 |
≤ 1등급으로 회복될 때까지 투여 일시 중단 후 감량 없이 투여 재개 |
|
두 번째 발현 시 |
≤ 1등급으로 회복될 때까지 투여 일시 중단 후 1차 감량(75%) 용량으로 투여 재개 | |
|
세 번째 발현 시 |
≤ 1등급으로 회복될 때까지 투여 일시 중단 후 2차 감량(56%) 용량으로 투여 재개 | |
|
네 번째 발현 시 |
치료 영구 중단 | |
|
3등급 이상반응 |
첫 번째 발현 시 |
≤ 1등급으로 회복될 때까지 투여 일시 중단 후 1차 감량(75%) 용량으로 투여 재개 |
|
두 번째 발현 시 |
≤ 1등급으로 회복될 때까지 투여 일시 중단 후 2차 감량(56%) 용량으로 투여 재개 | |
|
세 번째 발현 시 |
치료 영구 중단 | |
|
4등급 이상반응 |
첫 번째 발현 시 |
≤ 1등급으로 회복될 때까지 투여 일시 중단 후 2차 감량(56%) 용량으로 투여 재개 |
|
두 번째 발현 시 |
치료 영구 중단 | |
2. 투여방법
이 약은 냉장보관 (2∼8℃)하였다가 투여 전부터 실온 (1∼30℃)에서 보관이 가능하며 (최대 30일), 투여 전 체온을 이용해 충분히 데운 상태에서 내용물이 완전히 투명해 짐을 확인한 후 빨대 등을 이용해 복용한다.
약물 투여 후 오심, 구토 등으로 인하여 정해진 용량이 모두 투여되지 않았더라도 재투약해서는 안되며 만약 아침 약물 투여 후 오심, 구토 등으로 저녁 투약이 어려울 경우는 다음날 아침 투여한다.
이 약 복용 후 30분 간은 가급적이면 물의 섭취를 제한하고 부득이 한 경우 한 컵(200cc정도) 이하의 물을 섭취하도록 권장한다.
사용상의 주의사항
제조 · 수입사
 복사
복사
- 회사명
- 회사 영문명
- english name
- 전화번호
- 홈페이지
- http://www.naver.com
법적 고지
(재)약학정보원은 정확하고 독립적인 의약품 정보를 제공하기 위해 노력합니다.
본 사이트의 정보는 식품의약품안전처 허가사항과 학술 자료를 기반으로 하나, 의학적 진단·처방을 대체할 수 없으며, 사용 전 반드시 의사, 약사 등 전문가와 상담하시기 바랍니다.
또한 편집 과정에서의 오류·누락, 허가사항 변경, 최신 연구 결과 반영 지연 등이 있을 수 있으며, 이로 인하여 발생하는 문제에 대해 (재)약학정보원은 법적 책임을 지지 않습니다.
본 사이트의 모든 콘텐츠에 대한 저작권은 (재)약학정보원에 있으며, 무단 복제·배포·전송·변형·게시행위를 금합니다.
매주기 제 1, 8, 15일에 1일 2회(아침, 저녁) 식후 1시간 경과 후 1회 200 mg/m2 복용한다.
과민반응 예방을 위한 예비 투약은 필요 없다.
체표면적에 따른 1회 투여량과 용량 조정에 따른 투여량은 아래 표<체표면적에 의한 용량 계산 및 감량 시 투여량>에 따른다.
<체표면적에 의한 용량 계산 및 감량 시 투여량>

주기 시작 시점에는 호중구 수 1,500 cell/mm3 이상, 혈소판 수 100,000 cell/mm3 이상을 만족해야 치료를 시작할 수 있으며 충족되지 않는 경우 투여를 연기한다.
약물 복용 시에는 환자들에게 독성이 나타나는지 주의하여 모니터해야 한다. 이 약의 투여에 의한 독성은 대증 치료, 투약 일시 중단 및 용량 조정에 의해 조절될 수도 있다. 한 번 감량을 경험한 환자는 추후에 증량하지 않는다.
<독성 발생 시 이 약의 용량조절기준>
|
혈액학적 독성 | ||
|
기준* |
발생빈도 |
용량조절 |
|
열성호중구 감소증 |
첫 번째 발현 시 |
1차 감량(75%) |
|
두 번째 발현 시 |
2차 감량(56%) | |
|
세 번째 발현 시 |
치료 영구 중단 | |
|
7일 이상 지속되는 4등급의 호중구감소증 |
첫 번째 발현 시 |
1차 감량(75%) |
|
두 번째 발현 시 |
2차 감량(56%) | |
|
세 번째 발현 시 |
치료 영구 중단 | |
|
4등급 혈소판감소증 |
첫 번째 발현 시 |
1차 감량(75%) |
|
두 번째 발현 시 |
2차 감량(56%) | |
|
세 번째 발현 시 |
치료 영구 중단 | |
|
임상적으로 의미있는 출혈을 동반한 3등급 혈소판감소증 |
첫 번째 발현 시 |
1차 감량(75%) |
|
두 번째 발현 시 |
2차 감량(56%) | |
|
세 번째 발현 시 |
치료 영구 중단 | |
|
비혈액학적 독성 | ||
|
3등급 이상 감각신경병증 |
첫 번째 발현 시 |
치료 영구 중단 |
|
기타 비혈액학적 독성 | ||
|
1등급 이상반응 |
모든 경우 |
투여용량 유지 |
|
2등급 이상반응 |
첫 번째 발현 시 |
≤ 1등급으로 회복될 때까지 투여 일시 중단 후 감량 없이 투여 재개 |
|
두 번째 발현 시 |
≤ 1등급으로 회복될 때까지 투여 일시 중단 후 1차 감량(75%) 용량으로 투여 재개 | |
|
세 번째 발현 시 |
≤ 1등급으로 회복될 때까지 투여 일시 중단 후 2차 감량(56%) 용량으로 투여 재개 | |
|
네 번째 발현 시 |
치료 영구 중단 | |
|
3등급 이상반응 |
첫 번째 발현 시 |
≤ 1등급으로 회복될 때까지 투여 일시 중단 후 1차 감량(75%) 용량으로 투여 재개 |
|
두 번째 발현 시 |
≤ 1등급으로 회복될 때까지 투여 일시 중단 후 2차 감량(56%) 용량으로 투여 재개 | |
|
세 번째 발현 시 |
치료 영구 중단 | |
|
4등급 이상반응 |
첫 번째 발현 시 |
≤ 1등급으로 회복될 때까지 투여 일시 중단 후 2차 감량(56%) 용량으로 투여 재개 |
|
두 번째 발현 시 |
치료 영구 중단 | |
2. 투여방법
이 약은 냉장보관 (2∼8℃)하였다가 투여 전부터 실온 (1∼30℃)에서 보관이 가능하며 (최대 30일), 투여 전 체온을 이용해 충분히 데운 상태에서 내용물이 완전히 투명해 짐을 확인한 후 빨대 등을 이용해 복용한다.
약물 투여 후 오심, 구토 등으로 인하여 정해진 용량이 모두 투여되지 않았더라도 재투약해서는 안되며 만약 아침 약물 투여 후 오심, 구토 등으로 저녁 투약이 어려울 경우는 다음날 아침 투여한다.
이 약 복용 후 30분 간은 가급적이면 물의 섭취를 제한하고 부득이 한 경우 한 컵(200cc정도) 이하의 물을 섭취하도록 권장한다.
1) 골수억제(주로 호중구감소증)는 이 약의 주요 용량제한 독성이다. 호중구수가 1,500 cells/mm3 이상 및 혈소판수가 100,000 cells/mm3 이상을 만족해야 이 약의 치료 시작과 다음 주기를 재개 할 수 있으며, 치료 중에도 혈구수를 자주 모니터링 해야 한다.
2. 다음 환자에는 투여하지 말 것
1) 이 약 또는 이 약의 구성성분에 대하여 심한 과민반응을 보인 기왕력이 있는 환자
2) 주기 시작 시점에 호중구 수가 1,500 cells/mm3 미만이거나 혈소판수가 100,000 cells/mm3 미만인 환자 (골수억제는 용량제한인자이며 감염증을 수반하고, 심각해질 가능성이 있다.)
3) 감염증을 합병하고 있는 환자 (골수억제로 인하여 감염증을 악화시킬 위험이 있다.)
4) 임부 또는 임신하고 있을 가능성이 있는 부인
3. 다음 환자에는 신중하게 투여할 것
1) 골수억제환자 (골수억제를 악화시킬 우려가 있다.)
2) 간장애 환자 (대사기능 등이 저하되므로 이상반응이 심하게 나타날 우려가 있다.)
3) 신장애 환자 (신기능이 저하되므로 이상반응이 심하게 나타날 우려가 있다.)
4) 고령자
5) 간질성 폐렴 또는 폐섬유증 환자(증상을 악화시킬 우려가 있다.)
6) 담즙산 분비에 이상이 있거나 있을 것으로 추정되는 환자(효과가 저해될 우려가 있다.)
4. 이상반응
이전에 5-FU 및/또는 백금계 약물로 치료받은 적이 있는 재발성 또는 전이성 위암 환자(n=236)에게 이 약을 단독 투여하였을 때 이 약의 인과관계와 상관없이 118명 중 115명(97.5%)에게서 이상반응이 발생하였다.
<임상시험에서 발생한 이상반응(≥5%)>
|
이상반응a |
발현율(%) | ||||
|
이 약 200 mg/m2 (n=118) |
파클리탁셀주사 175 mg/m2 (n=118) | ||||
|
모든 등급 |
3등급 이상 |
모든 등급 |
3등급 이상 | ||
|
골수 |
호중구 감소증 |
55.1 |
42.4 |
63.6 |
53.4 |
|
빈혈 |
36.4 |
14.4 |
29.7 |
15.3 | |
|
백혈구 감소증 |
30.5 |
18.6 |
40.7 |
16.9 | |
|
혈소판 감소증 |
5.9 |
<1 |
11.0 |
<1 | |
|
발열성 호중구감소증 |
5.9 |
5.9 |
2.5 |
2.5 | |
|
위장관계 |
설사 |
35.6 |
<1 |
18.6 |
1.7 |
|
구역 |
34.7 |
1.7 |
15.3 |
0 | |
|
복통 |
29.7 |
2.5 |
26.3 |
1.7 | |
|
구토 |
28.0 |
2.5 |
9.3 |
1.7 | |
|
구내염 |
20.3 |
3.4 |
10.2 |
<1 | |
|
변비 |
11.9 |
0 |
13.6 |
0 | |
|
복부팽만 |
8.5 |
0 |
3.4 |
0 | |
|
소화불량 |
5.9 |
0 |
7.6 |
<1 | |
|
위장출혈 |
2.5 |
2.5 |
<1 |
<1 | |
|
전신 장애 및 투여 부위 상태 |
피로 |
30.5 |
4.2 |
18.6 |
2.5 |
|
발열 |
10.2 |
<1 |
11.0 |
0 | |
|
말초 부종 |
9.3 |
0 |
4.2 |
0 | |
|
면역반응이상 |
아나필락시스 |
<1 |
<1 |
2.5 |
2.5 |
|
감염 |
상기도감염 |
5.1 |
<1 |
3.4 |
0 |
|
불면증 |
불면증 |
8.5 |
0 |
3.4 |
0 |
|
간 |
AST 상승 |
6.8 |
1.7 |
6.8 |
3.4 |
|
ALT 상승 |
5.9 |
<1 |
5.9 |
2.5 | |
|
빌리루빈 상승 |
4.2 |
1.7 |
4.2 |
2.5 | |
|
ALP 상승 |
3.4 |
2.5 |
10.2 |
5.9 | |
|
대사 및 영양 |
식욕감퇴 |
34.7 |
3.4 |
31.4 |
2.5 |
|
저알부민혈증 |
11.0 |
2.5 |
10.2 |
<1 | |
|
저인산혈증 |
8.5 |
7.6 |
3.4 |
3.4 | |
|
고칼슘혈증 |
5.9 |
5.1 |
5.9 |
5.9 | |
|
고칼륨혈증 |
5.1 |
<1 |
<1 |
<1 | |
|
저나트륨혈증 |
4.2 |
4.2 |
3.4 |
3.4 | |
|
몸무게 감소 |
2.5 |
0 |
5.1 |
<1 | |
|
근골격계 및 결합조직 |
근육통 |
23.7 |
2.5 |
43.2 |
1.7 |
|
근력 약화 |
12.7 |
4.2 |
12.7 |
4.2 | |
|
요통 |
5.9 |
0 |
5.1 |
0 | |
|
옆구리통증 |
5.1 |
0 |
<1 |
0 | |
|
관절통 |
1.7 |
0 |
7.6 |
<1 | |
|
신경계 장애 |
말초신경병증 |
21.2 |
2.5 |
44.1 |
8.5 |
|
어지럼증 |
6.8 |
<1 |
7.6 |
0 | |
|
감각이상 |
5.9 |
0 |
18.6 |
0 | |
|
호흡기, 흉부 및 종격동 |
폐렴 |
10.2 |
4.2 |
1.7 |
1.7 |
|
기침 |
8.5 |
0 |
5.1 |
0 | |
|
객담 수반 기침 |
8.5 |
0 |
3.4 |
<1 | |
|
호흡 곤란 |
5.9 |
2.5 |
7.6 |
2.5 | |
|
흉막 삼출 |
<1 |
<1 |
4.2 |
3.4 | |
|
피부 및 피하조직 |
탈모 |
34.7 |
0 |
59.3 |
0 |
|
소양증 |
6.8 |
<1 |
8.5 |
0 | |
|
두드러기 |
5.1 |
0 |
7.6 |
<1 | |
|
혈관계 |
저혈압 |
3.4 |
2.5 |
1.7 |
0 |
|
a * 미국 국립암연구소(National Cancer Institute, NCI) 이상반응 표준 용어 기준(CTCAE, Common Terminology Criteria for Adverse Events) | |||||
2) 감염 : 이 약 투여를 받은 환자의 14.4%에서 감염 사례가 나타났으며, 이 중 5.1%에서 중증 감염이 나타났다. 중증 감염으로는 폐렴, 패혈증, 요도감염, 후두염, 상기도감염이 포함되었으며 이 중 1.7%에서 발생한 패혈증의 1% 미만은 심각한 영향을 초래하였다.
3) 과민반응 : 아나필락시스는 1건이 보고되었으나 이 약과의 연관성으로 보고되지 않았으며, 중증의 과민반응은 보고되지 않았다. 경증의 과민반응은 2.5%에서 보고되었다.
4) 출혈 : 위장출혈은 2.5%의 환자에서 발생되었으며, 기저질환으로 인한 것으로 약과의 연관성은 확인할 수 없었다.
5) 심혈관계 : 0.8%의 환자에서 중증 고혈압과 2.5% 환자에서 중증 저혈압 사례가 보고되었으며 이 약과의 연관성은 확인되지 않았다.
6) 호흡기계 : 이 약 투여 후에 폐렴(10.2%), 호흡곤란(5.9%), 기침(8.5%)등이 나타날 수 있다. 4.2%에서 중증의 폐렴이 보고되었으며 이로 인해 이 약의 치료를 중단하였다.
7) 신경계 : 이 약을 투여 받은 환자 중 21.2%에서 말초신경병증이 발생하였다. 이 중의 2.5%가 3 등급 이상의 중증의 말초신경병증이었으며 이로 인해 이 약의 치료 를 중단하였다. 이러한 증상이 나타난 경우에는 감량, 휴약 등 적절한 용량 조정이 필요하다.
8) 위장관계 : 이 약을 복용한 환자의 35.6%에서 설사가 나타났으며, 이 중 1% 미만에서 3 등급 설사가 나타났다. 증상은 일반적으로 일시적이었으며 자연적으로 해소되거나 심한 경우 대증적 치료가 권장된다.
9) 관절통/근육통 : 이 약의 복용 후 23.7%에서 근육통이 나타났으며, 1.7%에서 관절통이 나타났다.
10) 간 : 이 약을 투여 받은 환자의 2.5%와 파클리탁셀 주사제를 투여 받은 환자의 5.9%에서 3 등급 또는 4 등급의 간 기능 수치 (ALP) 상승이 보고되었다.
11) 신장 : 이 약을 복용한 1.7%에서 비감염성 방광염이 나타났으며, 중증은 보고되지 않았다.
12) 기타 임상 반응: 34.7%의 환자에게서 탈모가 나타났으며, 경증의 소양증이 6.8%, 두드러기가 5.1% 보고되었다.
파클리탁셀 제제의 시판 후 조사
1) 대사 및 영양 이상 : 파클리탁셀 성분 제제를 투여받은 환자에게서 종양용해증후군이 보고되었다.
※ 재심사에 따른 국내 시판 후 조사 결과
국내에서 재심사를 위하여 6년 동안 33명을 대상으로 실시한 시판 후 조사 결과, 이상사례의 발현율은 인과관계와 상관없이 93.94%(31/33명, 총 112건)로 보고되었다. 이 중 인과관계를 배제할 수 없는 중대한 약물이상반응 및 인과관계를 배제할 수 없는 예상하지 못한 약물이상반응은 발현 빈도에 따라 아래 표에 나열하였다.
|
발현빈도 |
기관계 |
중대한 약물이상반응 6.06%(2/33명, 2건) |
예상하지 못한 약물이상반응 12.12%(4/33명, 5건) |
|
흔하지 않게 (1~10% 미만) |
호흡기, 흉곽 및 종격 장애 |
- |
딸꾹질, 인두 궤양화 |
|
피부 및 피하 조직 장애 |
- |
손발톱 탈락, 손발톱 변색 | |
|
각종 위장관 장애 |
결장염, 설사 |
결장염 |
1) 이 약(파클리탁셀)은 암화학요법제 사용 경험이 있는 의사의 감독 및 지도하에 투여되어야 한다.
2) 발열 : 발열 빈도가 높으므로 충분히 관찰하고, 증상이 나타나는 경우에는 감염에 대해 충분히 관리하고, 해열제를 투여하는 등 적절히 처치하여야 한다.
3) 신경계 : 말초신경병증은 용량 및 투여 일정에 의존적으로 나타날 수 있다. 3 등급 이상의 감각신경독성이 발생하는 경우 이 약 치료를 중지하고 적절히 처치하여야 한다.
4) 폐렴 환자 : 이 약 투여 후에 폐렴 (10.2%)이 나타났으며, 4.2%가 중증의 폐렴이었다. 환자의 폐렴징후 및 증상을 모니터링하고 의심되는 폐렴을 평가하는 동안에는 이 약의 치료를 일시 중단하여야 한다.
5) 간 : 파클리탁셀 노출과 파클리탁셀의 독성으로 인해 간 손상이 증가할 수 있기 때문에 간장애 환자에게 이 약을 투여할 때는 주의해야 한다.
6. 상호작용
1) 이 약은 P당단백질에 의해 배출되고, 사이토크롬 P450 (CYP2C8과 CYP3A4)에 의해 대사된다. 상호작용에 대한 임상시험이 없으므로 P당단백질 및 사이토크롬 P450 (CYP2C8과 CYP3A4)의 기질 또는 억제제(리토나비어, 사퀴나비어, 인디나비어, 넬피나비어, 클로피도그렐)로 알려진 것과의 병용투여 시 주의하여야 한다. P당단백질 및 사이토크롬 P450에 대한 억제 또는 유도에 상당한 영향을 미칠 수 있기 때문에 병용 투여 시 주의하여야 한다.
2) 비타민 A, 아졸계 항진균제(케토코나졸, 미코나졸 등), 마크로라이드계 항생제(에리스로마이신 등), 스테로이드 호르몬제(에치닐에스트라디올 등), 디히드로피리딘계 칼슘채널차단제(니페디핀 등), 테르페나딘, 싸이클로스포린, 베라파밀, 퀴니딘, 미다졸람, 페나세틴, 리토나비어, 사퀴나비어, 인디나비어, 넬피나비어: 이 약의 대사를 저해하여 혈중농도가 상승하여 골수독성 등의 이상반응이 증가할 수 있으므로 병용할 경우에는 환자의 상태를 면밀하게 관찰하여야 한다.
7. 임부, 수유부에 대한 투여
1) 임부: 임부에 대한 이 약의 안전성·유효성은 평가되지 않았다. 가임여성의 경우, 이 약으로 치료하는 동안에는 임신을 피하도록 해야 한다. 만약 이 약을 임신 중이나 이 약을 복용하던 중에 임신이 되었다면 환자에게 태아에 대한 잠재적 위험성을 알려야만 한다.
2) 수유부: 이 약이 모유로 분비되는지는 알려져 있지 않다. 이 약을 수유부에게 투여 하지 않거나, 투여할 경우에는 수유를 중지한다.
8. 소아 등에 대한 투여
소아 환자에서 이 약의 안전성·유효성은 평가되지 않았다.
9. 고령자에 대한 투여
이 약은 고령자에 대해 별도의 연구를 진행하지 않았다. 그러나 고령자에서는 일반적으로 생리 기능이 저하되어 있는 경우가 많고 골수억제 등이 나타나기 쉬우므로 용량 및 투여간격에 유의하고 임상검사 (혈액검사, 간 기능검사, 신 기능검사 등)를 자주 하는 등 주의하여야 한다.
10. 과량 투여 시의 처치
이 약 과량투여 시 알려진 해독제는 없다. 과량투여 시 일차적으로 예상되는 합병증은 골수억제이다.
11. 적용상의 주의
이 약은 세포독성이 있는 항암제이므로 독성이 있는 다른 화합물과 같이 주의하여 취급해야 한다. 장갑 사용이 권장된다. 이 약이 피부나 점막에 노출되었을 경우, 즉시 세척하고, 비누와 물로 노출된 부위를 깨끗이 씻어내야 한다.
12. 보관 및 취급상의 주의사항
1) 어린이나 복용하지 않는 가족의 손이 닿지 않는 곳에 보관한다.
2) 다른 용기에 바꾸어 넣는 것은 사고원인이 되거나 품질 유지면에서 바람직하지 않으므로 이를 주의하여야 한다.
3) 이 약은 물과 섞이지 않으므로 복용 후 병에 묻은 잔여 약물을 물에 헹구어 복용해서는 안된다. 또한 복용한 빈 병은 다른 용도로 사용해서는 안된다.
4) 이 약이 든 병을 끊는 물에 데우거나, 전자레인지 등을 이용하여서는 안된다.
5) 이 약은 냉장(2∼8℃) 보관한다. 다만, 부득이한 경우 최대한 30일 동안 실온(1∼30℃) 보관 가능하며, 이후에는 폐기하여야 한다.
6) 이 약의 취급 및 폐기시에는 항암제를 위한 적절한 취급과정에 따라야 한다.

