| 제품명 |
|
|||
|---|---|---|---|---|
| 성분 / 함량 | 동일성분 의약품 | |||
| 첨가제 | ||||
| 도핑금지 약물정보 |
|
|||
| 전문 / 일반 |
|
단일 / 복합 | ||
| 제조 / 수입사 | ||||
| 제형 | 투여경로 | |||
| 성상 | ||||
| 허가일 |
|
|||
| 의약품심사결과 | [변경]키스칼리정200밀리그램(리보시클립숙신산염) 의약품 품목변경허가 보고서[한국노바티스(주), 키스칼리정200밀리그램(리보시클립숙신산염)](공개용)202509.pdf [신약]키스칼리정200밀리그램(리보시클립숙신산염) 20191223_[신약]키스칼리정200밀리그램(리보시클립숙신산염).pdf | |||
| 재심사 | ||||
| 대조 / 생동 | ||||
| 급여평가결과 | 급여(B), 2020년 제08차 평가결과_키스칼리정(한국노바티스(주)).pdf 회의자료_키스칼리정(한국노바티스(주)).pdf | |||
| 급여정보 |
653603270 - 34828원/1정 급여(2025-06-01) - 38697원/1정 급여(2024-04-01) - 41967원/1정 급여(2020-11-01)
|
|||
| 급여인정기준 |
· [일반원칙] 국민건강보험 요양급여의 기준에 관한 규칙 제5조제4항에 의하여 중증환자 중 암환자에게 처방·투여하는 약제로서 건강보험심사평가원장이 정하여 공고하는 약제의 범위 및 비용부담 , 2019.11.01
|
|||
| ATC 코드 | ||||
| 식약처 분류 | ||||
| KPIC 약효분류 |
|
|||
| KPIC 학술 |
팜리뷰
[Special Issue] 암 환자의 퇴원 후 관리, 약학정보원(최은경), 2022-12-30
팜리뷰
항암치료와 구내염, 약학정보원(최선), 2017-06-12
팜리뷰
완화치료(palliative care), 약학정보원(남궁형욱), 2017-05-15
팜리뷰
비만과 여성암(2), 약학정보원(최혁재), 2017-03-13
팜리뷰
비만과 여성암(1), 약학정보원(최혁재), 2017-03-06
팜리뷰
항암화학요법 시 부작용 경감을 위한 한방의 병용(I) - 소화기계 부작용, 약학정보원(송보완), 2017-02-20
|
|||
| 대한약사저널 |
이슈트랜드
암 위험인자로서의 비만, 약학정보원 학술정보센터, 2020-08-10
|
|||
| 제품설명서 | 보 기 ( 2017-10-10 게시 ) | |||
| 의약품안전성 정보(DUR) |
||||
| 포장단위 (식약처 기준) |
|
|||
| 저장방법 | ||||
사용자GNB바
컨텐츠
의약품 상세정보
허가정보 ∙ 복약정보
효능 · 효과
조기유방암
폐경 전, 폐경 이행기 여성 및 남성에서 아로마타제 억제제는 황체 형성 호르몬 분비 호르몬(Luteinizing hormone releasing hormone, LHRH) 작용제와 병용해야 한다.
진행성 또는 전이성 유방암
이 약은 호르몬 수용체(HR) 양성 및 사람 상피세포성장인자 수용체2(HER2) 음성인 진행성 또는 전이성 유방암환자에서 다음과 같이 병용한다.
▪ 폐경 전, 폐경이행기, 또는 폐경 후 여성에서 1차 내분비요법으로서 아로마타제 억제제와 병용
▪ 폐경 후 여성에서 1차 내분비요법 또는 내분비요법 후 질환이 진행된 경우 풀베스트란트와 병용
폐경 전, 폐경 이행기 여성에서 아로마타제 억제제 또는 풀베스트란트는 황체 형성 호르몬 분비 호르몬(LHRH) 작용제와 병용해야 한다.
용법 · 용량
1. 권장 용량 및 투여 일정
폐경 전, 폐경 이행기 여성에서 임상 진료 지침에 따라 황체 형성 호르몬 분비 호르몬(LHRH) 효능제와 병용해야 한다.
조기유방암
이 약의 권장 용량은 28일을 전체 주기로 하여, 1일 1회 400 mg을(200 mg 필름코팅정 2정) 21일간 연속하여 경구 투여하고, 7일간 휴약한다.
조기유방암 환자에서 이 약은 3년 동안, 또는 질병이 재발하거나 허용될 수 없는 독성이 발생할 때까지 계속해서 투여해야 한다.
이 약과 아로마타제 억제제를 병용 투여 시, 아로마타제 억제제의 용량 및 투여는 아로마타제 억제제의 허가사항을 참조한다.
폐경 전, 폐경 이행기 여성 및 남성에서 임상 진료 지침에 따라 황체 형성 호르몬 분비 호르몬(LHRH) 작용제와 병용해야 한다.
진행성 또는 전이성 유방암
이 약의 권장 용량은 28일을 전체 주기로 하여, 1일 1회 600 mg을(200mg 필름코팅정 3정)을 21일간 연속하여 경구투여하고, 7일간 휴약한다.
이 약과 아로마타제 억제제를 병용 투여 시, 아로마타제 억제제의 권장용량을 투여한다(허가사항 참조).
이 약과 풀베스트란트를 병용 투여 시, 풀베스트란트의 권장용량은 500mg을 1일, 15일차, 29일차에 투여하며, 그 이후로는 한달에 1번 투여한다(허가사항 참조).
폐경 전, 폐경 이행기 여성에서 임상 진료 지침에 따라 황체 형성 호르몬 분비 호르몬(LHRH) 작용제와 병용해야 한다.
조기 유방암 및 진행성 또는 전이성 유방암 환자는 이 약과 아로마타제 억제제를 되도록이면 아침에, 매일 대략의 정해진 시간대에 복용하는 것이 권장된다.
환자가 이 약 복용 후 구토를 하거나 복용을 잊은 경우, 이 약을 추가로 투여해서는 안 된다. 다음 용량의 투여는 예정된 복용 시간에 이루어져야 한다. 이 약은 삼키기 전 씹거나 부수거나 쪼개지 말고 통째로 삼켜야 한다. 알약이 부서지거나 금이 가는 등 온전하지 않은 경우, 복용해서는 안 된다.
2. 용량 조절
1) 이상 반응에 따른 용량 조절
이상반응에 따른 용량 조절은 [표1]을 따른다.
[표1] 이상반응에 따른 용량 조절
|
조기유방암 |
투여 용량 |
정제의 개수 |
|
시작 용량 |
400mg/day |
200mg 2정 |
|
용량 감소 |
200mg/day* |
200mg 1정 |
|
진행성 또는 전이성 유방암 |
투여 용량 |
정제의 개수 |
|
시작 용량 |
600 mg/day |
200mg 3정 |
|
1차 용량 감소 |
400 mg/day |
200mg 2정 |
|
2차 용량 감소 |
200 mg/day* |
200mg 1정 |
|
*200 mg/day 이하로 용량 감소가 더 필요한 경우 투여를 중단한다. | ||
[표 2] 용량 조절 및 관리 ‑ 호중구 감소증
|
이 약 투여를 시작하기 전 전혈구검사(Complete Blood Counts)를 수행한다. 처음 2주기의 매 2주 동안, 이어지는 4 주기의 각 시작 시점 및 임상적으로 요구되는 경우 전혈구 수(CBC)를 모니터링 한다. | ||
|
|
CTCAE 등급 |
용량 조절 |
|
호중구 감소증 |
1또는 2등급 (ANC 1000/mm3 -< LLN) |
용량 조절 필요 없음. |
|
3등급 (ANC 500 -< 1000/mm3) |
2등급 이하로 회복 될 때까지 일시중단한다. 투여를 재개할 경우, 이전과 동일한 용량으로 재개한다. 3등급의 독성이 재발하면, 회복될 때까지 일시 중단한 후, 한 단계 낮은 용량으로 이 약의 투여를 재개한다. | |
|
3등급 열성* 호중구감소증 |
2등급 이하로 호중구감소증이 회복 될 때까지 일시중단한다. 투여를 재개할 경우,한 단계 낮은 투여 용량 수준으로 재개한다. | |
|
4등급 (ANC<500/mm3) |
2등급 이하로 회복 될 때까지 일시중단한다. 투여를 재개할 경우, 한 단계 낮은 투여 용량 수준으로 재개한다. | |
|
* 3등급 호중구 감소증 중, 38.3℃를 넘는 단회성발열이 있거나 38℃ 이상의 열이 1시간 이상 지속되는 경우 및/또는 동시감염을 동반하는 경우. CTCAE 4.03에 따라 등급 지정. CTCAE= Common Terminology Criteria for Adverse Events(이상반응 표준 용어 기준) ANC= absolute neutrophil count(절대 호중구수) LLN= lower limit of normal(정상 하한치) | ||
|
이 약 투여를 시작하기 전, 간 기능 검사를 수행한다. 처음 2주기의 매 2주 동안, 이어지는 4주기의 각 시작 시 및 임상적으로 요구 되는 경우 간 기능 검사를 모니터링 한다. 2등급 이상의 이상수치가 관찰되면 더 잦은 모니터링이 권장된다. | ||
|
|
CTCAE 등급 |
용량 조절 |
|
AST 및/또는ALT 가 베이스라인보다 증가*하고, 총 빌리루빈이 ULN 2배를 초과하지 않는 경우 |
1등급 (>ULN ~ 3 ULN) |
용량 조절 필요 없음. |
|
2 등급 (> 3 ~ 5 ULN) |
베이스라인*이 2등급 미만인 경우: 베이스라인등급 이하로 회복 될 때까지 투약을 일시 중단 한 후, 동일한 용량으로 투여 재개한다. 2등급으로 재발하면, 한 단계 낮은 투여 용량 수준으로 이 약을 투여 재개한다. 베이스라인*이 2등급인 경우: 투여 중단 없음. | |
|
3 등급(> 5 ~ 20 ULN) |
베이스라인*등급 이하로 회복 될 때까지 투약을 일시 중단 한 후 한 단계 낮은 용량 수준으로 투여 재개한다. 3등급으로 재발하면, 이 약의 투여를 중단한다. | |
|
4등급(> 20 ULN) |
이 약의 투여를 중단한다. | |
|
담즙 정체가 없는 상태에서 총 빌리루빈 증가를 동반한 AST 및/또는 ALT증가 |
베이스라인*등급과 관계없이 총 빌리루빈이 >2 ULN이면서 ALT 및/또는 AST이 > 3 ULN이면 이 약의 투여를 중단한다. | |
|
* 베이스라인=치료 개시 전 CTCAE 4.03에 따라 등급 지정 ULN = 정상 상한 AST = 아스파르테이트아미노전달효소 ALT = 알라닌아미노전달효소 | ||
|
QTcF 연장 |
조기유방암 |
진행성 또는 전이성 유방암 |
|
>480ms 및 ≤500ms |
QTcF 연장이 481 ms 미만으로 개선 될 때 까지 투여를 중단한다. | |
|
동일한 용량으로 투여를 재개한다. |
한 단계 낮은 투여 용량 수준으로 투여를 재개한다. | |
|
만약 QTcF가 481ms 이상으로 재발한다면 QTcF가 481ms 미만으로 개선될 때까지 이 약의 투여를 중단한다. 그 다음 한 단계 낮은 투여 용량 수준으로 투여를 재개한다. | ||
|
>500ms |
만약 QTcF가 481ms 미만으로 개선된다면 한 단계 낮은 투여 용량 수준으로 투여를 재개한다.
만약 QTcF가 500ms 초과로 재발한다면 이 약의 투여를 중단한다. | |
|
만약 QTcF 간격이 500ms 보다 크거나 베이스라인으로부터 60ms 보다 크게 변화하면서 다음과 같은 증상이 나타나는 경우 이 약을 영구적으로 중단한다: Torsades de Pointes, 다형성 심실성 빈맥, 원인 불명의 실신, 또는 중증 부정맥의 증후/증상
| ||
|
200mg/day 이하로 추가 용량 감소가 필요한 경우 투여를 중단한다. 심전도(ECG)는 치료 시작 전에 평가되어야 한다. 첫 번째 주기의 약 14일째 및 임상적으로 요구되는 경우 ECG를 실시한다. 치료 중 어느 때라도 QTcF 연장이 나타나는 경우, 조기 유방암 및 진행성 또는 전이성 유방암 환자에서 더 잦은 ECG 모니터링을 권고한다. * QTcF = Fridericia의 공식으로 보정한 QT 간격 | ||
|
CTCAE 등급 |
용량 조절 |
|
1등급(무증상) |
용량 조절 필요 없음. 적절한 의학 치료를 시작하고 임상적 필요에 따라 모니터한다. |
|
2등급(증상있음) |
1등급 이하로 회복 될 때까지 투약을 일시 중단하고, 한 단계 낮은 용량*수준으로 투여 재개를 고려한다. 2등급으로 재발하면, 이 약의 투여를 중단한다. |
|
3등급(중증) 혹은4등급(생명을 위협함) |
이 약의 투여를 중단한다. |
|
CTCAE 4.03에 따라 등급 지정 *이 약의 투여재개를 고려할 때에는 개별화된 이익-위험분석이 수행되어야 한다. | |
|
기타 독성 | |
|
1 또는 2 등급 |
용량 조절 필요 없음. 적절한 의학 치료를 시작하고 임상적필요에 따라 모니터한다. |
|
3등급 |
1등급 이하로 회복될 때까지 일시중단한 다음, 동일한 용량으로 투여 재개한다. 3등급으로 재발하면, 한 단계 낮은 용량 수준으로 투여를 재개한다. |
|
4등급 |
이 약의 투여를 중단한다. |
|
* 호중구 감소증, 간 독성 및 간질성 폐질환/폐렴, QT 간격 연장을 제외. CTCAE 4.03에 따라 등급 지정 | |
2) 강력한 CYP3A 저해제와 병용 투여 시의 용량 조절
이 약과 강력한 CYP3A 저해제와의 병용을 피하고 CYP3A 저해 가능성이 적은 대체 병용 약물을 고려한다.
조기 유방암 환자에서 강력한 CYP3A 저해제와 반드시 병용투여해야 하는 경우, 이상반응에 대한 관찰이 필요하며 필요 시 이 약의 용량을 200 mg으로 감량한다.
진행성 또는 전이성 유방암 환자에서 강력한 CYP3A 저해제와 병용투여해야 하는 경우, 이 약의 용량을 1일 1회 400mg으로 감량한다. 강력한 저해제의 투여를 중단하는 경우, 이 약의 용량을 강력한 CYP3A 저해제 시작 이전의 용량으로 변경한다. 강력한 CYP3A 저해제의 반감기의 최소 5배가 지난 이후이어야 한다.
3) 간장애에서의 용량 조절
조기 유방암 및 간 장애 환자에서 용량 조절은 필요하지 않다.
경증의 간장애 환자(Child ‑Pugh class A)에 있어서 용량 조절은 필요하지 않다. 중등도(Child ‑Pugh class B) 및 중증(Child ‑Pugh class C)의 간장애를 가진 진행성 또는 전이성 유방암 환자에서 이 약의 권장하는 시작 용량은 1일 1회 400mg이다. 중등도 및 중증 간장애 유방암 환자에서 이 약은 연구되지 않았다.
병용 투여한 아로마타제 억제제 또는 풀베스트란트의 간장애와 연관된 용량 조절에 대해서는 해당 약물의 허가사항을 참조한다.
4) 신장애에서의 용량 조절
경증에서 중등도의 신장애 환자에 있어서 용량 조절은 필요하지 않다. 중증의 신장애 환자에 있어서 권장시작 용량은 1일 1회 200mg이다. 중증 신장애 유방암 환자에서 이 약은 연구되지 않았다.
사용상의 주의사항
제조 · 수입사
 복사
복사
- 회사명
- 회사 영문명
- english name
- 전화번호
- 홈페이지
- http://www.naver.com
법적 고지
(재)약학정보원은 정확하고 독립적인 의약품 정보를 제공하기 위해 노력합니다.
본 사이트의 정보는 식품의약품안전처 허가사항과 학술 자료를 기반으로 하나, 의학적 진단·처방을 대체할 수 없으며, 사용 전 반드시 의사, 약사 등 전문가와 상담하시기 바랍니다.
또한 편집 과정에서의 오류·누락, 허가사항 변경, 최신 연구 결과 반영 지연 등이 있을 수 있으며, 이로 인하여 발생하는 문제에 대해 (재)약학정보원은 법적 책임을 지지 않습니다.
본 사이트의 모든 콘텐츠에 대한 저작권은 (재)약학정보원에 있으며, 무단 복제·배포·전송·변형·게시행위를 금합니다.
이 약은 호르몬 수용체(hormone receptor, HR) 양성 및 사람 상피세포 성장인자 수용체 2(human epidermal growth factor receptor 2, HER2) 음성이며 재발 위험이 높은 2기 및 3기 조기 유방암 환자에서 보조요법으로서 아로마타제 억제제와 병용한다.
폐경 전, 폐경 이행기 여성 및 남성에서 아로마타제 억제제는 황체 형성 호르몬 분비 호르몬(Luteinizing hormone releasing hormone, LHRH) 작용제와 병용해야 한다.
진행성 또는 전이성 유방암
이 약은 호르몬 수용체(HR) 양성 및 사람 상피세포성장인자 수용체2(HER2) 음성인 진행성 또는 전이성 유방암환자에서 다음과 같이 병용한다.
▪ 폐경 전, 폐경이행기, 또는 폐경 후 여성에서 1차 내분비요법으로서 아로마타제 억제제와 병용
▪ 폐경 후 여성에서 1차 내분비요법 또는 내분비요법 후 질환이 진행된 경우 풀베스트란트와 병용
폐경 전, 폐경 이행기 여성에서 아로마타제 억제제 또는 풀베스트란트는 황체 형성 호르몬 분비 호르몬(LHRH) 작용제와 병용해야 한다.
이 약은 음식과 함께 또는 무관하게 복용할 수 있다.
폐경 전, 폐경 이행기 여성에서 임상 진료 지침에 따라 황체 형성 호르몬 분비 호르몬(LHRH) 효능제와 병용해야 한다.
조기유방암
이 약의 권장 용량은 28일을 전체 주기로 하여, 1일 1회 400 mg을(200 mg 필름코팅정 2정) 21일간 연속하여 경구 투여하고, 7일간 휴약한다.
조기유방암 환자에서 이 약은 3년 동안, 또는 질병이 재발하거나 허용될 수 없는 독성이 발생할 때까지 계속해서 투여해야 한다.
이 약과 아로마타제 억제제를 병용 투여 시, 아로마타제 억제제의 용량 및 투여는 아로마타제 억제제의 허가사항을 참조한다.
폐경 전, 폐경 이행기 여성 및 남성에서 임상 진료 지침에 따라 황체 형성 호르몬 분비 호르몬(LHRH) 작용제와 병용해야 한다.
진행성 또는 전이성 유방암
이 약의 권장 용량은 28일을 전체 주기로 하여, 1일 1회 600 mg을(200mg 필름코팅정 3정)을 21일간 연속하여 경구투여하고, 7일간 휴약한다.
이 약과 아로마타제 억제제를 병용 투여 시, 아로마타제 억제제의 권장용량을 투여한다(허가사항 참조).
이 약과 풀베스트란트를 병용 투여 시, 풀베스트란트의 권장용량은 500mg을 1일, 15일차, 29일차에 투여하며, 그 이후로는 한달에 1번 투여한다(허가사항 참조).
폐경 전, 폐경 이행기 여성에서 임상 진료 지침에 따라 황체 형성 호르몬 분비 호르몬(LHRH) 작용제와 병용해야 한다.
조기 유방암 및 진행성 또는 전이성 유방암 환자는 이 약과 아로마타제 억제제를 되도록이면 아침에, 매일 대략의 정해진 시간대에 복용하는 것이 권장된다.
환자가 이 약 복용 후 구토를 하거나 복용을 잊은 경우, 이 약을 추가로 투여해서는 안 된다. 다음 용량의 투여는 예정된 복용 시간에 이루어져야 한다. 이 약은 삼키기 전 씹거나 부수거나 쪼개지 말고 통째로 삼켜야 한다. 알약이 부서지거나 금이 가는 등 온전하지 않은 경우, 복용해서는 안 된다.
2. 용량 조절
1) 이상 반응에 따른 용량 조절
이상반응에 따른 용량 조절은 [표1]을 따른다.
[표1] 이상반응에 따른 용량 조절
|
조기유방암 |
투여 용량 |
정제의 개수 |
|
시작 용량 |
400mg/day |
200mg 2정 |
|
용량 감소 |
200mg/day* |
200mg 1정 |
|
진행성 또는 전이성 유방암 |
투여 용량 |
정제의 개수 |
|
시작 용량 |
600 mg/day |
200mg 3정 |
|
1차 용량 감소 |
400 mg/day |
200mg 2정 |
|
2차 용량 감소 |
200 mg/day* |
200mg 1정 |
|
*200 mg/day 이하로 용량 감소가 더 필요한 경우 투여를 중단한다. | ||
[표 2] 용량 조절 및 관리 ‑ 호중구 감소증
|
이 약 투여를 시작하기 전 전혈구검사(Complete Blood Counts)를 수행한다. 처음 2주기의 매 2주 동안, 이어지는 4 주기의 각 시작 시점 및 임상적으로 요구되는 경우 전혈구 수(CBC)를 모니터링 한다. | ||
|
|
CTCAE 등급 |
용량 조절 |
|
호중구 감소증 |
1또는 2등급 (ANC 1000/mm3 -< LLN) |
용량 조절 필요 없음. |
|
3등급 (ANC 500 -< 1000/mm3) |
2등급 이하로 회복 될 때까지 일시중단한다. 투여를 재개할 경우, 이전과 동일한 용량으로 재개한다. 3등급의 독성이 재발하면, 회복될 때까지 일시 중단한 후, 한 단계 낮은 용량으로 이 약의 투여를 재개한다. | |
|
3등급 열성* 호중구감소증 |
2등급 이하로 호중구감소증이 회복 될 때까지 일시중단한다. 투여를 재개할 경우,한 단계 낮은 투여 용량 수준으로 재개한다. | |
|
4등급 (ANC<500/mm3) |
2등급 이하로 회복 될 때까지 일시중단한다. 투여를 재개할 경우, 한 단계 낮은 투여 용량 수준으로 재개한다. | |
|
* 3등급 호중구 감소증 중, 38.3℃를 넘는 단회성발열이 있거나 38℃ 이상의 열이 1시간 이상 지속되는 경우 및/또는 동시감염을 동반하는 경우. CTCAE 4.03에 따라 등급 지정. CTCAE= Common Terminology Criteria for Adverse Events(이상반응 표준 용어 기준) ANC= absolute neutrophil count(절대 호중구수) LLN= lower limit of normal(정상 하한치) | ||
|
이 약 투여를 시작하기 전, 간 기능 검사를 수행한다. 처음 2주기의 매 2주 동안, 이어지는 4주기의 각 시작 시 및 임상적으로 요구 되는 경우 간 기능 검사를 모니터링 한다. 2등급 이상의 이상수치가 관찰되면 더 잦은 모니터링이 권장된다. | ||
|
|
CTCAE 등급 |
용량 조절 |
|
AST 및/또는ALT 가 베이스라인보다 증가*하고, 총 빌리루빈이 ULN 2배를 초과하지 않는 경우 |
1등급 (>ULN ~ 3 ULN) |
용량 조절 필요 없음. |
|
2 등급 (> 3 ~ 5 ULN) |
베이스라인*이 2등급 미만인 경우: 베이스라인등급 이하로 회복 될 때까지 투약을 일시 중단 한 후, 동일한 용량으로 투여 재개한다. 2등급으로 재발하면, 한 단계 낮은 투여 용량 수준으로 이 약을 투여 재개한다. 베이스라인*이 2등급인 경우: 투여 중단 없음. | |
|
3 등급(> 5 ~ 20 ULN) |
베이스라인*등급 이하로 회복 될 때까지 투약을 일시 중단 한 후 한 단계 낮은 용량 수준으로 투여 재개한다. 3등급으로 재발하면, 이 약의 투여를 중단한다. | |
|
4등급(> 20 ULN) |
이 약의 투여를 중단한다. | |
|
담즙 정체가 없는 상태에서 총 빌리루빈 증가를 동반한 AST 및/또는 ALT증가 |
베이스라인*등급과 관계없이 총 빌리루빈이 >2 ULN이면서 ALT 및/또는 AST이 > 3 ULN이면 이 약의 투여를 중단한다. | |
|
* 베이스라인=치료 개시 전 CTCAE 4.03에 따라 등급 지정 ULN = 정상 상한 AST = 아스파르테이트아미노전달효소 ALT = 알라닌아미노전달효소 | ||
|
QTcF 연장 |
조기유방암 |
진행성 또는 전이성 유방암 |
|
>480ms 및 ≤500ms |
QTcF 연장이 481 ms 미만으로 개선 될 때 까지 투여를 중단한다. | |
|
동일한 용량으로 투여를 재개한다. |
한 단계 낮은 투여 용량 수준으로 투여를 재개한다. | |
|
만약 QTcF가 481ms 이상으로 재발한다면 QTcF가 481ms 미만으로 개선될 때까지 이 약의 투여를 중단한다. 그 다음 한 단계 낮은 투여 용량 수준으로 투여를 재개한다. | ||
|
>500ms |
만약 QTcF가 481ms 미만으로 개선된다면 한 단계 낮은 투여 용량 수준으로 투여를 재개한다.
만약 QTcF가 500ms 초과로 재발한다면 이 약의 투여를 중단한다. | |
|
만약 QTcF 간격이 500ms 보다 크거나 베이스라인으로부터 60ms 보다 크게 변화하면서 다음과 같은 증상이 나타나는 경우 이 약을 영구적으로 중단한다: Torsades de Pointes, 다형성 심실성 빈맥, 원인 불명의 실신, 또는 중증 부정맥의 증후/증상
| ||
|
200mg/day 이하로 추가 용량 감소가 필요한 경우 투여를 중단한다. 심전도(ECG)는 치료 시작 전에 평가되어야 한다. 첫 번째 주기의 약 14일째 및 임상적으로 요구되는 경우 ECG를 실시한다. 치료 중 어느 때라도 QTcF 연장이 나타나는 경우, 조기 유방암 및 진행성 또는 전이성 유방암 환자에서 더 잦은 ECG 모니터링을 권고한다. * QTcF = Fridericia의 공식으로 보정한 QT 간격 | ||
|
CTCAE 등급 |
용량 조절 |
|
1등급(무증상) |
용량 조절 필요 없음. 적절한 의학 치료를 시작하고 임상적 필요에 따라 모니터한다. |
|
2등급(증상있음) |
1등급 이하로 회복 될 때까지 투약을 일시 중단하고, 한 단계 낮은 용량*수준으로 투여 재개를 고려한다. 2등급으로 재발하면, 이 약의 투여를 중단한다. |
|
3등급(중증) 혹은4등급(생명을 위협함) |
이 약의 투여를 중단한다. |
|
CTCAE 4.03에 따라 등급 지정 *이 약의 투여재개를 고려할 때에는 개별화된 이익-위험분석이 수행되어야 한다. | |
|
기타 독성 | |
|
1 또는 2 등급 |
용량 조절 필요 없음. 적절한 의학 치료를 시작하고 임상적필요에 따라 모니터한다. |
|
3등급 |
1등급 이하로 회복될 때까지 일시중단한 다음, 동일한 용량으로 투여 재개한다. 3등급으로 재발하면, 한 단계 낮은 용량 수준으로 투여를 재개한다. |
|
4등급 |
이 약의 투여를 중단한다. |
|
* 호중구 감소증, 간 독성 및 간질성 폐질환/폐렴, QT 간격 연장을 제외. CTCAE 4.03에 따라 등급 지정 | |
2) 강력한 CYP3A 저해제와 병용 투여 시의 용량 조절
이 약과 강력한 CYP3A 저해제와의 병용을 피하고 CYP3A 저해 가능성이 적은 대체 병용 약물을 고려한다.
조기 유방암 환자에서 강력한 CYP3A 저해제와 반드시 병용투여해야 하는 경우, 이상반응에 대한 관찰이 필요하며 필요 시 이 약의 용량을 200 mg으로 감량한다.
진행성 또는 전이성 유방암 환자에서 강력한 CYP3A 저해제와 병용투여해야 하는 경우, 이 약의 용량을 1일 1회 400mg으로 감량한다. 강력한 저해제의 투여를 중단하는 경우, 이 약의 용량을 강력한 CYP3A 저해제 시작 이전의 용량으로 변경한다. 강력한 CYP3A 저해제의 반감기의 최소 5배가 지난 이후이어야 한다.
3) 간장애에서의 용량 조절
조기 유방암 및 간 장애 환자에서 용량 조절은 필요하지 않다.
경증의 간장애 환자(Child ‑Pugh class A)에 있어서 용량 조절은 필요하지 않다. 중등도(Child ‑Pugh class B) 및 중증(Child ‑Pugh class C)의 간장애를 가진 진행성 또는 전이성 유방암 환자에서 이 약의 권장하는 시작 용량은 1일 1회 400mg이다. 중등도 및 중증 간장애 유방암 환자에서 이 약은 연구되지 않았다.
병용 투여한 아로마타제 억제제 또는 풀베스트란트의 간장애와 연관된 용량 조절에 대해서는 해당 약물의 허가사항을 참조한다.
4) 신장애에서의 용량 조절
경증에서 중등도의 신장애 환자에 있어서 용량 조절은 필요하지 않다. 중증의 신장애 환자에 있어서 권장시작 용량은 1일 1회 200mg이다. 중증 신장애 유방암 환자에서 이 약은 연구되지 않았다.
1) 간질성폐질환/폐렴
중증, 생명을 위협하거나, 치명적인 간질성 폐질환(Interstitial Lung Disease, ILD) 및/또는 폐렴이 이 약 혹은 다른 CDK4/6억제제를 복용하는 환자에게서 발생할 수도 있다.
조기 유방암 환자를 대상으로 한 3상 임상시험에서 이 약 + 아로마타제 억제제군 중 간질성폐질환/폐렴(1 ‑2 등급)이 나타난 경우는 1.5%였다. 간질성 폐질환은 이 약 + 아로마타제 억제제군에서 1명(1등급), 아로마타제 억제제 단독군에서는 발생하지 않았다. 폐렴(모든 등급, 0.6% 및 0.4%)은 이 약 + 아로마타제 억제제군 및 아로마타제 억제제 단독군에서 보고되었으며, 아로마타제 억제제 단독군에서 2건의 3등급 폐렴이 보고되었다. 이 약 + 아로마타제 억제제군에서는 3등급의 폐렴이 보고되지 않았다.
진행성 또는 전이성 유방암 환자를 대상으로 한 3상 임상시험에서 이 약을 투여받은 환자군 중 간질성폐질환/폐렴이 나타난 경우는 모든 등급 1.1%, 3등급 또는 4등급 0.3%이었고 0.1%는 치명적이었다. 시판 후 조사에서 간질성폐질환/폐렴의 사례가 관찰되었으며, 사망사례가 보고되었다.
폐렴은 이 약 투여군과 위약 투여군에서 각각 모든 등급 0.6%, 0.4%으로 보고되었으며 3등급, 또는 4등급의 폐렴은 두 군 모두 없었다.
간질성 폐질환/폐렴의 중증도에 따라 [표5]에 기술된 대로 치료 중단, 용량 감량 및 영구 중단 등이 필요할 수 있다. 저산소증, 기침, 호흡곤란 등 간질성폐질환/폐렴을 시사하는 폐증상이 환자에게 나타나는지 모니터링 한다.
2) QT 간격 연장
이 약은 QT 간격을 농도 의존적으로 연장시키는 것으로 나타났다.
다음의 질환을 가진 자를 포함하여, QT 연장이 있거나 QT 연장이 발생할 유의미한 위험성을 가진 환자에게는 이 약의 사용을 피해야 한다.
◦ QT연장 증후군
◦ 조절되지 않거나 유의한 심장 질환(최근 발생한 심근 경색, 울혈성 심부전, 불안정 협심증 및 서맥성 부정맥을 포함)
◦ 전해질 이상
QT 간격을 연장시키는 약 및/또는 QTc 간격의 연장을 야기할 수도 있는 강력한 CYP3A 저해제와 병용투여해서는 안 된다.
3상 임상시험(NATALEE)에서 이 약 400 mg과 아로마타제 억제제를 병용한 조기 유방암 환자의 ECG를 평가하였을 때, 3명(0.1%)에서 500 ms를 초과하는 post baseline QTcF 값을 보였고, 19명(0.8%)은 베이스라인에 비해 60 ms가 넘는 QTcF 간격 증가를 보였다. Torsades de Pointes 증례는 보고된 바 없다.
진행성 또는 전이성 유방암 환자에게 이 약 600 mg과 아로마타제 억제제 또는 풀베스트란트를 병용투여한 3상 임상시험(MONALEESA ‑2, MONALEESA ‑7 및 MONALEESA ‑3)에서, 15명(1.4%)이 500 ms를 초과하는 post ‑baseline QTcF 값을 보였고, 61명(5.8%)은 베이스라인에 비해 60 ms가 넘는 QTcF 간격 증가를 보였다. Torsades de Pointes 증례는 보고된 바 없다.
임상시험 MONALEESA ‑2에서, 이 약과 레트로졸을 병용투약한 환자 중 1명(0.3%)에게서 갑작스런 사망이 발생했고 3등급 저칼륨혈증 및 2등급 QT 연장을 동반하였다. 임상시험 MONALEESA ‑3 또는 MONALEESA ‑7에서 갑작스런 사망 증례는 보고된 바 없다.
치료 시작 전 ECG를 평가해야 한다. QTcF 값이 450 ms 미만인 환자에게만 이 약의 치료를 시작해야 한다. 첫 번째 주기의 약 14일 째와 임상적으로 요구되는 경우 ECG를 반복한다.
치료 시작 전, 첫 6주기의 시작시점 및 임상적으로 요구되는 경우, 조기 유방암 및 진행성 또는 전이성 유방암 환자의 치료 시작 전에 혈청 전해질(칼륨, 칼슘, 인산, 마그네슘 포함)을 모니터링 한다. 이 약의 치료를 시작하기 전에 전해질 이상을 교정한다.
조기 유방암 및 진행성 또는 전이성 유방암 환자의 치료 중 관찰된 QT 연장에 근거하여 이 약은 [표4]에 기술된 대로 일시중단, 감량 또는 투여 중단이 필요할 수 있다.
3) 타목시펜 병용투여 시 QT 연장의 증가
이 약과 타목시펜과의 병용투여는 승인되지 않았다. 임상시험 MONALEESA ‑7에서, 베이스라인보다 증가된 QTcF의 평균값은 타목시펜 + 위약군이 비스테로이드성 아로마타제 억제제(NSAI) + 위약군 보다 > 10 ms 만큼 높았다.
위약군에서, 베이스라인보다 60 ms 초과하여 증가한 경우는 타목시펜을 투여받은 환자 90명 중 6명(6.7%)에서 나타났으며, NSAI를 투여받은 환자에서는 나타나지 않았다. QTcF 간격이 베이스라인으로부터 60 ms 초과하여 증가한 경우는 이 약+타목시펜 투여군 87명 중 14명(16.1%)에서 나타났으며 이 약 + NSAI 투여군 245명 중 18명(7.3%)에게서 나타났다.
4) 간담도 독성
조기 유방암 및 진행성 또는 전이성 유방암 환자를 대상으로 한 3상 임상시험에서 아미노 전이 효소의 증가가 관찰되었다.
조기 유방암 환자에서 3 또는 4등급의 ALT(7.6 % vs 0.7%)와 AST(4.7% vs 0.5%) 증가가 각각 이 약 + 아로마타제 억제제군 및 아로마타제 억제제 단독군에서 관찰되었다. 이 약 + 아로마타제 억제제군에서 4등급의 ALT 증가(1.5%)와 AST 증가(0.8%)가 보고되었으며, 아로마타제 억제제 단독군에서는 4등급의 AST 증가가 보고되지 않았다. 아로마타제 억제제 단독군에서 4등급의 ALT 증가가 1건(<0.1%) 보고되었다.
3상 임상시험에서 80.9%(204명 중 165명)의 환자에서 3 또는 4등급 ALT 또는 AST 증가가 치료 시작 후 첫 6개월 이내에 발생하였다. 대부분의 ALT 및 AST 증가는 빌리루빈 증가를 동반하지 않았다. 3 또는 4등급의 ALT/AST 증가를 경험한 환자에게서 증상이 나타나는데 걸린 시간의 중앙값은 이 약 + 아로마타제 억제제군에서 2.8 개월이었다. 증상 완화(정상화 또는 2등급 이하)에 걸린 시간의 중앙값은 이 약 + 아로마타제 억제제군에서 0.7 개월이었다.
정상 알칼리 인산 분해 효소를 가지는 경우에서, ALT 또는 AST > 3 ULN 및 총 빌리루빈 값> 2 ULN 의 동반 상승은 이 약 + 아로마타제 억제제군에서 8명의 환자에서 나타났다. (6명의 환자에서 이 약 중단 후 65일에서 303일 이내에 ALT 또는 AST 수치가 정상으로 회복되었다.)
진행성 또는 전이성 유방암 환자 대상 임상시험(MONALEESA ‑2, MONALEESA ‑7, MONALEESA ‑3)에서 아미노전이효소의 증가가 관찰되었다. 연구 전반적으로, 3 또는 4등급의 ALT(11.2% vs 1.7%)와 AST(7.8% vs 2.1%) 증가가 이 약과 위약에서 각각 관찰되었다.
3등급 이상의 ALT/AST 증가를 보이는 환자에서, 이 약과 아로마타제 억제제 또는 풀베스트란트를 병용 투여한 환자군에서 증상이 나타나는데 걸린 시간의 중앙값은 92일이었다. 2등급 이하로 완화되는데 걸린 시간의 중앙값은 이 약과 아로마타제 억제제 또는 풀베스트란트를 병용 투여한 환자군에서 21일이었다. 임상시험 MONALEESA ‑2와 MONALEESA ‑3에서, 담즙 정체의 증상이 없고 정상 알칼리인산분해효소를 가지는 경우에서 ‘ALT/or AST >3 ULN’과 ‘총 빌리루빈>2 ULN’의 동반 상승은 6명(1%)의 환자에게서 나타났으며 모든 환자는 이 약의 투여 중단 후 회복되었다. MONALEESA ‑7 연구에서는 일어나지 않았다.
조기유방암 및 진행성 또는 전이성 유방암 환자에서 이 약으로 치료를 시작하기 전에 간기능검사를 수행해야 한다. 첫 2주기 동안은 매 2주마다, 이어지는 4 주기 동안은 각 주기의 시작 시점에, 그리고 임상적으로 요구되는 경우 간기능을 모니터링해야 한다.
아미노전이효소 증가의 중증도에 따라 이 약은 [표3] ‘용량 조절 및 관리 ‑ 간담도독성’에 기술한 대로 일시 중단, 감량 또는 투여 중단이 필요할 수 있다.
베이스라인에서 3등급 이상으로 증가된 AST / ALT를 가진 환자에 대한 권장 사항은 확립되지 않았다.
5) 호중구감소증
이 약은 호중구 감소증을 농도 의존적으로 유발한다. 발열 시 즉시 알리도록 안내되어야 한다.
조기 유방암 환자 대상 제3상 임상시험에서(NATALEE(O12301C)) 이 약 + 아로마타제 억제제군 중 호중구 감소증은 가장 빈번하게 보고된 이상반응이었으며(62.5%), 3/4 등급의 호중구 수치 감소(검사실 소견에 근거)는 이 약 + 아로마타제 억제제를 병용 투여한 환자의 45.1%에서 보고되었다.
조기 유방암 환자 중 2, 3, 4 등급의 호중구 감소증을 보인 환자에 있어서 2등급 이상의 호중구 감소증이 발생하기까지 걸린 기간의 중앙값은 0.6개월이었다. 3등급 이상에서 소실까지 걸린 기간(3등급 미만 또는 정상화)의 중앙값은 이 약과 아로마타제 억제제 병용투여군에서 0.3 개월이었다. 열성 호중구 감소증은 이 약과 아로마타제 억제제 병용투여군의 0.3%에서 보고되었다.
진행성 또는 전이성 유방암 환자에서(3상 임상시험MONALEESA ‑2(A2301), MONALEESA ‑7(E1201, NSAI), MONALEESA ‑3(F2301)) 호중구감소증은 가장 빈번히 보고된 이상 반응이었으며(75.4%), 3/4 등급의 호중구 수치 감소(검사실 소견에 근거)는 이 약과 아로마타제 억제제 또는 풀베스트란트를 병용 투여한 환자의 62.2%에서 보고되었다. 2, 3, 4등급의 호중구감소증 환자에 있어서 2등급 이상의 호중구감소증이 발생하기까지 걸린 기간의 중앙값은 17일이었다. 이 약과 아로마타제 억제제 또는 풀베스트란트를 병용 투여한 환자군에서, 3등급 이상에서 소실까지 걸린 기간(3등급 미만 또는 정상화)의 중앙값은 12일이었다. 열성 호중구감소증은 이 약과 아로마타제 억제제 또는 풀베스트란트를 병용 투여한 환자의 1.7%에서 보고되었다.
이 약 투여를 시작하기 전 전혈구(CBC) 검사를 수행한다. 첫 2주기동안은 매 2주마다, 이어지는 4주기 동안은 각 주기의 시작시점, 그리고 임상적으로 요구되는 경우 전혈구 수를 모니터링 한다.
호중구 감소증의 중등도에 따라, [표2]에 기술된 바와 같이 이 약의 일시 중단, 감량 또는 투여 중단이 필요할 수 있다.
6) 배 ‑태아 독성
동물시험 및 이 약의 작용 기전에 근거할 때, 이 약은 임부에 투여 시 태아에게 유해할 수 있다.
동물의 생식독성시험에서, 임신한 랫드 및 토끼에 이 약을 투여 시, 각각 사람노출량 0.6배와 1.5배에 상응하는 모체 노출량(곡선 하 면적, AUC에 근거함)에서 배태자 독성이 나타났다. 임부에게는 태아에 대한 잠재적 위험성에 대해 알려야 한다.
가임 여성에게는 이 약의 치료기간 동안, 그리고 마지막 용량 투여 후 최소 3주동안은 효과적인 피임법을 사용하도록 권고한다.
7) 중증피부반응
이 약의 치료에 따른 독성표피괴사용해(TEN)가 보고되었다. 만약 중증 피부반응이 의심되는 증후 및 증상(수포 또는 점막 병변이 흔히 동반되는 진행성의 광범위한 피부 발진)이 나타나면 이 약은 즉시 및 영구적으로 중단되어야 한다.
2. 다음 환자에는 신중히 투여할 것
1) 간질성 폐질환이 있는 환자 또는 간질성 폐질환 기왕력이 있는 환자(간질성 폐질환이 악화될 가능성이 있음)
3. 이상 반응
안전성 프로파일의 요약
1) 조기 유방암
이 약의 전반적인 안전성 프로파일이 HR ‑양성, HER2 ‑음성의 조기 유방암 환자에서 진행한 공개 3상 임상시험(NATALEE)에서 이 약과 아로마타제 억제제를 병용한 2,525명 환자의 자료를 기반으로 하여 아래와 같이 보고되었다. 임상시험에서 이 약 투여 기간의 중앙값은 32.9개월이었으며 69.4%의 환자가 24개월 이상, 42.8%의 환자가 36개월의 이 약 투여를 완료하였다.
이상반응으로 인한 용량 감량은, 그 인과관계와 무관하게, 이 약과 아로마타제 억제제를 병용한 환자의 22.8%에서 나타났다.
이상반응으로 인한 이 약의 영구적인 중단은 이 약과 아로마타제 억제제를 병용한 환자에서 19.7%로 나타났다. 영구 중단에 이르게 하는 가장 흔한 부작용은 ALT 상승(7.1%), AST 상승(2.8%) 그리고 관절통(1.5%) 이다.
치료 도중 사망한 경우는 이 약과 아로마타제 억제제를 병용한 환자 중 20명(0.8%)에서 보고되었다. 치명적인 이상반응은 이 약과 아로마타제 억제제를 병용한 환자 중 11명(0.4%)에서 보고되었고, 모두 이 약과는 무관하였다.
임상시험(NATALEE)에서 가장 흔하게 나타난 이상반응(20% 이상의 빈도와 아로마타제 억제제 단독 투여군보다 더 잦은 빈도로 보고된 반응들)은 호중구 감소증, 감염, 구역, 두통, 피로, 백혈구 감소증, 간기능 수치 이상이다.
가장 흔하게 나타난 3등급 이상의 이상반응(2% 이상의 빈도로 보고되었으며, 아로마타제 억제제 단독 투여군 보다 이 약에서 더 잦은 빈도로 보고된 반응들)은 호중구감소증, 간기능 수치 이상, 백혈구 감소증이다.
2) 진행성 또는 전이성 유방암
이 약의 전반적인 안전성 프로파일은 HR ‑양성, HER2 ‑음성의 진행성 또는 전이성 유방암 환자에서 진행한 이중맹검, 위약대조, 3상 임상시험(MONALEESA ‑2, MONALEESA ‑7 ‑NSAI군, MONALEESA ‑3)에서 이 약과 내분비요법을 병용한 환자 총 1065명의(아로마타제 억제제와 병용 582명, 풀베스트란트와 병용 483명) 통합데이터셋 자료를 기반으로 하여 아래와 같이 보고되었다. 3상 임상시험에서 이 약 투여 기간의 중앙값은 19.2개월이었으며, 61.7%의 환자가 12개월 이상 이 약을 투여받았다. 원인과 관계없이 이상반응으로 인한 용량 감량은 병용 약제와 무관하게 이 약을 투여 받은 환자의 39.5%, 위약군의 4.3 %로 나타났다. 이상반응으로 인한 영구적인 중단은 병용 약제와 무관하게 이 약을 투여 받은 환자의 8.7%, 위약군에서는 3.1%로 나타났다. 영구 중단에 이르게 하는 가장 흔한 부작용은 ALT 상승(4.5%), AST 상승(2.5%) 그리고 구토(1.1%) 이다.
임상 3상 시험의 통합 분석에서, 치료 도중 사망한 경우는 병용 약제와 무관하게 이 약 투여군에서 22건(2.1%), 위약군에서는 16건(2.0%)이며, 사망의 주요 원인인 질병 진행을 제외하면, 병용 약제와 무관하게 이 약 투약군 중 3명에게서 치료와 관련한 사망이 발생했다. 사망의 원인은 급성 호흡곤란 증후군 1건(0.1%), 급성 호흡 부전 2건(0.2%) 그리고 갑작스러운 사망(3 등급 저칼륨혈증 및 2등급 QT 연장) 1건(0.1%) 이었다. 3상 임상시험에서 가장 많이 나타난 이상반응(20% 이상의 빈도와 위약군 보다 이 약 투여군에서 더 잦은 빈도로 보고된 반응들)은 호중구 감소증, 감염, 구역, 피로, 설사, 백혈구 감소증, 구토, 두통, 변비, 탈모, 기침, 두드러기, 요통, 빈혈, 간기능 수치 이상이다.
가장 흔하게 나타난 3/4 등급 이상반응(2% 이상의 빈도로 보고되었으며, 위약군 보다 이 약 투여군에서 더 잦은 빈도로 보고된 반응들)은 호중구감소증, 백혈구감소증, 간 기능 수치 이상, 림프구감소증, 감염, 요통, 빈혈, 피로, 저인산혈증 그리고 구토가 있다.
3) 이상반응 요약 표
조기 유방암 및 진행성 또는 전이성 유방암 환자에서 3상 임상시험을 통해 보고된 이상반응은 아래 [표7]~[표10]에 기술되어 있다. 임상시험을 통해 분석된 이상반응은 MedDRA 기관분류별로, 빈도에 따라 나열하였으며 가장 흔하게 나타난 반응 순으로 먼저 기재되었다. 각 빈도 내에서 이상반응은 중증도가 감소하는 순서로 기재되었다. 또한, 각 이상반응의 빈도수는 CIOMS III 에 따라 다음의 용어를 사용하였다. : 매우 흔하게( ≧ 1/10), 흔하게( ≧1/100, <1/10), 흔하지 않게( ≧1/1,000, <1/100), 드물게( ≧1/10,000, <1/1,000), 매우 드물게(<1/10,000)
조기 유방암
[표7]. NATALEE 임상시험을 기반으로 한 조기 유방암 환자에서의 이상반응
|
이상반응 |
이 약 N=2525 n (%) 모든 등급 |
아로마타제 억제제(AI) N=2442 n (%) 모든 등급 |
이 약 N=2525 n (%) 3등급 이상 |
아로마타제 억제제(AI) N=2442 n (%) 3등급 이상 |
빈도수 모든등급 |
|
감염 | |||||
|
감염¹ |
917 (36.3) |
642 (26.3) |
49 (1.9) |
23 (0.9) |
매우 흔하게 |
|
혈액 및 림프계 | |||||
|
호중구감소증 |
1,577 (62.5) |
113 (4.6) |
1113 (44.1) |
22 (0.9) |
매우 흔하게 |
|
백혈구감소증 |
564 (22.3) |
88 (3.6) |
184 (7.3) |
8 (0.3) |
매우 흔하게 |
|
빈혈 |
215 (8.5) |
75 (3.1) |
8 (0.3) |
7 (0.3) |
흔하게 |
|
혈소판감소증 |
162 (6.4) |
56 (2.3) |
6 (0.2) |
3 (0.1) |
흔하게 |
|
림프구감소증 |
124 (4.9) |
39 (1.6) |
30 (1.2) |
2 (0.1) |
흔하게 |
|
발열성호중구감소증 |
7 (0.3) |
0 |
7 (0.3) |
0 |
흔하지 않게 |
|
대사 및 영양 | |||||
|
저칼슘혈증 |
134 (5.3) |
26 (1.1) |
1 (<0.1) |
0 |
흔하게 |
|
저칼륨혈증 |
121 (4.8) |
41 (1.7) |
8 (0.3) |
7 (0.3) |
흔하게 |
|
식욕부진 |
120 (4.8) |
47 (1.9) |
1 (<0.1) |
0 |
흔하게 |
|
신경계 | |||||
|
두통 |
580 (23.0) |
417 (17.1) |
11 (0.4) |
4 (0.2) |
매우 흔하게 |
|
어지러움 |
225 (8.9) |
112 (4.6) |
5 (0.2) |
2 (0.1) |
흔하게 |
|
호흡기계, 흉부 및 종격동 | |||||
|
기침 |
332 (13.1) |
201 (8.2) |
3 (0.1) |
2 (0.1) |
매우 흔하게 |
|
호흡 곤란 |
166 (6.6) |
102 (4.2) |
13 (0.5) |
10 (0.4) |
흔하게 |
|
소화기계 | |||||
|
구역 |
588 (23.3) |
190 (7.8) |
6 (0.2) |
1 (<0.1) |
매우 흔하게 |
|
설사 |
366 (14.5) |
135 (5.5) |
16 (0.6) |
3 (0.1) |
매우 흔하게 |
|
변비 |
335 (13.3) |
123 (5.0) |
5 (0.2) |
0 |
매우 흔하게 |
|
복통2 |
277 (11.0) |
179 (7.3) |
12 (0.5) |
9 (0.4) |
매우 흔하게 |
|
구토 |
198 (7.8) |
96 (3.9) |
10 (0.4) |
1 (<0.1) |
흔하게 |
|
구내염3 |
154 (6.1) |
24 (1.0) |
2 (0.1) |
0 |
흔하게 |
|
간 및 담도계 | |||||
|
간독성4 |
36 (1.4) |
13 (0.5) |
16 (0.6) |
1 (<0.1) |
흔하게 |
|
피부 및 피하조직 | |||||
|
탈모 |
380 (15.0) |
109 (4.5) |
0 |
0 |
매우 흔하게 |
|
발진5 |
233 (9.2) |
85 (3.5) |
4 (0.2) |
3 (0.1) |
흔하게 |
|
가려움증 |
188 (7.4) |
77 (3.2) |
2 (0.1) |
1 (<0.1) |
흔하게 |
|
일반적 장애 및 투여부위 상태 | |||||
|
피로 |
564 (22.3) |
322 (13.2) |
19 (0.8) |
4 (0.2) |
매우 흔하게 |
|
무기력증 |
428 (17.0) |
291 (11.9) |
14 (0.6) |
3 (0.1) |
매우 흔하게 |
|
발열 |
280 (11.1) |
147 (6.0) |
5 (0.2) |
2 (0.1) |
매우 흔하게 |
|
말초부종 |
183 (7.2) |
121 (5.0) |
1 (<0.1) |
0 |
흔하게 |
|
구강인두 통증 |
154 (6.1) |
81 (3.3) |
0 |
0 |
흔하게 |
|
검사치 | |||||
|
간수치이상6 |
563 (22.3) |
186 (7.6) |
197 (7.8) |
25 (1.0) |
매우 흔하게 |
|
심전도QT 연장 |
109 (4.3) |
18 (0.7) |
7 (0.3) |
1 (<0.1) |
흔하게 |
|
혈중 크레아티닌 상승 |
98 (3.9) |
22 (0.9) |
3 (0.1) |
0 |
흔하게 |
|
감염1: 요로 감염, 호흡기계 감염 복통2: 복통, 상복부통 구내염3: 구내염, 점막염 간독성4: 간 용해, 약물로 인한 간 손상, 간 독성, 자가면역 간염(단일사례) 발진5: 발진, 반구점 발진, 소양증 발진 간수치이상6: ALT 상승, AST 상승, 혈중 빌리루빈 상승 | |||||
아래 [표8]에 NATALEE 임상3상시험을 통해 분석된 조기 유방암 환자에서 임상적으로 유의미한 비정상적 혈액학적, 생화학적 검사치가 기술되어 있다.
[표8]. 조기 유방암 환자에서 NATALEE 임상시험 자료를 기반으로 한 이상 임상 검사치
|
이상반응 |
이 약 N=2525 n (%) 모든 등급 |
아로마타제 억제제(AI) N=2442 n (%) 모든 등급 |
이 약 N=2525 n (%) 3/4등급 |
아로마타제 억제제(AI) N=2442 n (%) 3/4등급 |
빈도수 모든등급 |
|
혈액학적 수치 | |||||
|
림프구 감소 |
2,460 (97.4) |
2,151 (88.1) |
480 (19.0) |
153 (6.3) |
매우 흔하게 |
|
백혈구 수 감소 |
2,407 (95.3) |
1,103 (45.2) |
693 (27.4) |
14 (0.6) |
매우 흔하게 |
|
호중구 수 감소 |
2,363 (93.6) |
859 (35.2) |
1,138 (45.1) |
41 (1.7) |
매우 흔하게 |
|
헤모글로빈 감소 |
1,192 (47.2) |
627 (25.7) |
14 (0.6) |
8 (0.3) |
매우 흔하게 |
|
혈소판 감소 |
715 (28.3) |
320 (13.1) |
10 (0.4) |
8 (0.3) |
매우 흔하게 |
|
생화학적 수치 | |||||
|
ALT 상승 |
1,131 (44.8) |
862 (35.3) |
205 (8.1) |
25 (1.0) |
매우 흔하게 |
|
AST 상승 |
1,111 (44.0) |
806 (33.0) |
133 (5.3) |
26 (1.1) |
매우 흔하게 |
|
크레아티닌 상승 |
822 (32.6) |
278 (11.4) |
7 (0.3) |
0 |
매우 흔하게 |
[표9]. 진행성 또는 전이성 유방암 환자에서 3상 임상시험 통합 자료를 기반으로 한 이상반응
|
이상반응 |
이 약 N=1065 n (%) 모든 등급 |
위약 N=818 n (%) 모든 등급 |
이 약 N=1065 n (%) 3/4 등급 |
위약 N=818 n (%) 3/4등급 |
빈도수 모든등급 |
|
감염 | |||||
|
감염¹ |
502 (47.1) |
282 (34.5) |
49 (4.6) |
12 (1.5) |
매우 흔하게 |
|
혈액 및 림프계 | |||||
|
호중구감소증 |
803 (75.4) |
54 (6.6) |
662 (62.2) |
18 (2.2) |
매우 흔하게 |
|
백혈구감소증 |
350 (32.9) |
27 (3.3) |
184 (17.3) |
5 (0.6) |
매우 흔하게 |
|
빈혈 |
228 (21.4) |
69 (8.4) |
41 (3.8) |
18 (2.2) |
매우 흔하게 |
|
림프구감소증 |
124 (11.6) |
21 (2.6) |
67 (6.3) |
8 (1.0) |
매우흔하게 |
|
혈소판감소증 |
105 (9.9) |
15 (1.8) |
9 (0.8) |
2 (0.2) |
흔하게 |
|
발열성호중구감소증 |
18 (1.7) |
2 (0.2) |
17 (1.6) |
2 (0.2) |
흔하게 |
|
눈 | |||||
|
눈물증가 |
77 (7.2) |
11 (1.3) |
0 |
0 |
흔하게 |
|
안구 건조 |
64 (6.0) |
24 (2.9) |
0 |
0 |
흔하게 |
|
대사 및 영양 | |||||
|
식욕부진 |
182 (17.1) |
110 (13.4) |
6 (0.6) |
1 (0.1) |
매우 흔하게 |
|
저칼슘혈증 |
50 (4.7) |
14 (1.7) |
12 (1.1) |
0 |
흔하게 |
|
저칼륨혈증 |
44 (4.1) |
23 (2.8) |
16 (1.5) |
6 (0.7) |
흔하게 |
|
저인산혈증 |
35 (3.3) |
12 (1.5) |
22 (2.1) |
7 (0.9) |
흔하게 |
|
신경계 | |||||
|
두통 |
290 (27.2) |
191 (23.3) |
7 (0.7) |
5 (0.6) |
매우 흔하게 |
|
어지러움 |
149 (14.0) |
93 (11.4) |
2 (0.2) |
1 (0.1) |
매우흔하게 |
|
현기증 |
64 (6.0) |
14 (1.7) |
2 (0.2) |
0 |
흔하게 |
|
심장 | |||||
|
실신 |
25 (2.3) |
13 (1.6) |
18 (1.7) |
8 (1.0) |
흔하게 |
|
호흡기, 흉곽 및 중격 | |||||
|
기침 |
258 (24.2) |
152 (18.6) |
0 |
0 |
매우 흔하게 |
|
호흡곤란 |
155 (14.6) |
95 (11.6) |
20 (1.9) |
8 (1.0) |
매우 흔하게 |
|
근골격, 결합 조직 | |||||
|
요통 |
256 (24.0) |
180 (22.0) |
23.0 (2.2) |
11 (1.3) |
매우 흔하게 |
|
소화기계 | |||||
|
구역 |
496 (46.6) |
242 (29.6) |
18 (1.7) |
5 (0.6) |
매우 흔하게 |
|
설사 |
354 (33.2) |
191 (23.3) |
20 (1.9) |
6 (0.7) |
매우 흔하게 |
|
구토 |
307 (28.8) |
143 (17.5) |
23 (2.2) |
3 (0.4) |
매우 흔하게 |
|
변비 |
271 (25.4) |
140 (17.1) |
9 (0.8) |
0 |
매우 흔하게 |
|
복통² |
208 (19.5) |
121 (14.8) |
16 (1.5) |
5 (0.6) |
매우 흔하게 |
|
구내염 |
147 (13.8) |
59 (7.2) |
4 (0.4) |
1 (0.1) |
매우 흔하게 |
|
소화불량 |
108 (10.1) |
48 (5.9) |
1 (0.1) |
0 |
매우흔하게 |
|
미각장애 |
75 (7.0) |
39 (4.8) |
1 (0.1) |
0 |
흔하게 |
|
간 및 담도계 | |||||
|
간독성3 |
20 (1.9) |
7 (0.9) |
16 (1.5) |
4 (0.5) |
흔하게 |
|
피부 및 피하조직 | |||||
|
탈모 |
268(25.2) |
102 (12.5) |
0 |
0 |
매우 흔하게 |
|
발진4 |
253 (23.8) |
81 (9.9) |
10 (0.9) |
1 (0.1) |
매우 흔하게 |
|
가려움증 |
197 (18.5) |
57 (7.0) |
5 (0.5) |
0 |
매우 흔하게 |
|
피부 건조 |
96 (9.0) |
23 (2.8) |
0 |
0 |
흔하게 |
|
홍반 |
55 (5.2) |
13 (1.6) |
2 (0.2) |
1 (0.1) |
흔하게 |
|
백반증 |
30 (2.8) |
0 |
1 (0.1) |
0 |
흔하게 |
|
일반적 장애 및 투여부위 상태 | |||||
|
피로 |
373 (35.0) |
263 (32.2) |
23 (2.2) |
5 (0.6) |
매우흔하게 |
|
말초부종 |
171 (16.1) |
83 (10.1) |
2 (0.2) |
0 |
매우 흔하게 |
|
발열 |
168 (15.8) |
60 (7.3) |
5 (0.5) |
1 (0.1) |
매우 흔하게 |
|
무기력증 |
161 (15.1) |
108 (13.2) |
10 (0.9) |
3 (0.4) |
매우 흔하게 |
|
구강인두 통증 |
87 (8.2) |
46 (5.6) |
0 |
0 |
흔하게 |
|
입마름 |
83 (7.8) |
51 (6.2) |
1 (0.1) |
0 |
흔하게 |
|
검사치 | |||||
|
간수치이상5 |
216 (20.3) |
89 (10.9) |
105 (9.9) |
17 (2.1) |
매우 흔하게 |
|
혈중 크레아티닌 상승 |
84 (7.9) |
20 (2.4) |
7 (0.7) |
0 |
흔하게 |
|
심전도QT 연장 |
73 (6.9) |
14 (1.7) |
14 (1.3) |
2 (0.2) |
흔하게 |
|
감염1: 요로 감염, 호흡기계 감염, 위장염, 패혈증(<1%) 복통2: 복통, 상복부통 간독성3: 간 용해, 간세포성 손상, 약물로 인한 간 손상, 간 독성, 간 부전, 자가면역 간염(단일사례) 발진4: 발진, 반구점 발진, 소양증 발진 간수치이상5: ALT 상승, AST 상승, 혈중 빌리루빈 상승 | |||||
아래 [표10]에 3상 임상시험을 통해 분석된 임상적으로 유의미한 비정상적 혈액학적, 생화학적 검사치가 기술되어 있다.
[표10]. 3상 임상시험 통합자료를 기반으로 한 이상 임상 검사치
|
이상 임상 검사치 |
이 약 N=1065 n (%) all grade |
위약 N=818 n (%) all grade |
이 약 N=1065 n (%) Grade 3/4 |
위약 N=818 n (%) Grade 3/4 |
빈도수 All grade |
|
혈액학적 수치 | |||||
|
백혈구 수 감소 |
1009 (94.7) |
268 (32.8) |
380 (35.7) |
10 (1.2) |
매우 흔하게 |
|
호중구 수 감소 |
994 (93.3) |
227 (27.8) |
660 (62.0) |
20 (2.4) |
매우 흔하게 |
|
헤모글로빈 감소 |
728 (68.4) |
339 (41.4) |
54 (5.1) |
19 (2.3) |
매우 흔하게 |
|
림프구 감소 |
703 (66.0) |
228 (27.9) |
209 (19.6) |
37 (4.5) |
매우 흔하게 |
|
혈소판 감소 |
366 (34.4) |
86 (10.5) |
16 (1.5) |
5 (0.6) |
매우 흔하게 |
|
생화학적 수치 | |||||
|
AST 상승 |
580 (54.5) |
343 (41.9) |
83 (7.8) |
17 (2.1) |
매우 흔하게 |
|
γ-GTP 상승1 |
390 (53.4) |
229 (46.9) |
67 (9.2) |
51 (10.5) |
매우 흔하게 |
|
ALT 상승 |
548 (51.5) |
315 (38.5) |
119 (11.2) |
14 (1.7) |
매우 흔하게 |
|
크레아티닌 상승 |
447 (42.0) |
121 (14.8) |
14 (1.3) |
2 (0.2) |
매우 흔하게 |
|
혈당 감소 |
216 (20.3) |
113 (13.8) |
3 (0.3) |
2 (0.2) |
매우 흔하게 |
|
인산 감소 |
190 (17.8) |
79(9.7) |
46 (4.3) |
8 (1.0) |
매우 흔하게 |
|
알부민 감소 |
122 (11.5) |
53 (6.5) |
1 (0.1) |
1 (0.1) |
매우 흔하게 |
|
칼륨 감소 |
118 (11.1) |
76 (9.3) |
22 (2.1) |
10 (1.2) |
매우흔하게 |
|
빌리루빈 증가 |
64 (6.0) |
46 (5.6) |
12 (1.1) |
9 (1.1) |
흔하게 |
|
1 MONALEESA-3, MONALEESA-7 임상시험에서 수집된 자료. 이 약 투여군731명 및 위약 투여군488명의 샘플 사이즈를 기반으로 한 자료 | |||||
이 약의 시판 후 경험에서 자발적 보고 및 문헌 사례를 통해 다음과 같은 약물 이상반응이 확인되었다. 이러한 반응은 불확실한 크기의 집단에서 자발적으로 보고된 것이기 때문에, 그 빈도수를 신뢰성 있게 추정하거나 약물 노출과의 인과관계를 확립하는 것이 항상 가능한 것은 아니다.
[표11]. 자발적 보고 및 문헌 사례를 통해 확인된 이상반응
|
이상반응 |
빈도수 |
|
호흡기, 흉곽 및 종격 | |
|
간질성 폐질환/폐렴(pneumonitis) |
알 수 없음 |
|
피부 및 피하조직 | |
|
독성표피괴사용해(TEN) |
알 수 없음 |
| 다형성 홍반 |
드물게1 |
5) 특정 이상반응
‑ 호중구 감소증
호중구 감소증의 중증도는 농도 의존적이다.
호중구 감소증은 조기 유방암 환자를 대상으로 한 3상 임상시험 중 빈번하게 보고된 임상 검사치 이상이다.
이 약과 아로마타제 억제제 병용군에서 호중구 감소증으로 인한 치료중단은 적었다(1.1%).
호중구 감소증은 진행성 또는 전이성 유방암을 대상으로 한 3상 임상시험 중 가장 빈번하게 보고된 임상검사치 이상이다.
병용 약제와 무관하게 이 약 투여군에서 호중구 감소증으로 인한 치료 중단은 적었다(0.8%).
중증도에 따라 검사치 모니터링, 용량 개입 및/또는 조절이 이루어졌다. 모든 환자들은 발열 시 즉시 알리도록 안내되어야 한다.
‑간담도독성
조기 유방암 환자를 대상으로 한 3상 임상시험에서 이 약과 아로마타제 억제제 병용군에서 아로마타제 억제제 단독군보다 간담도 독성 발생률이 더 높았으며(26.4%, 11.2%), 3/4단계 이상반응 또한 이 약과 아로마타제 억제제 병용군에서 더 높았다. (8.6%, 1.7%).
조기 유방암 환자 중 이 약과 아로마타제 억제제 병용군에서 간담도 독성으로 인한 일시 중단은 12.4%이며, 주로 ALT 상승(10.1%) 및/또는 AST 상승(6.8%) 이었다. 이 약과 아로마타제 억제제 병용군에서 간담도 독성으로 인한 용량 조절은 2.6%이며, 주로 ALT 상승(1.9%) 및/또는 AST 상승(0.6%)으로 인한 용량 조절이었다. 이 약군에서 간수치 이상 및 간 독성으로 인한 치료 중단은 각각 8.9%, 0.1%였다.
진행성 또는 전이성 유방암 환자를 대상으로 한 3상 임상시험에서 각각 병용 약제와 무관하게 이 약군에서 위약군보다 간담도 독성 발생률이 더 높았으며(27.3% vs 19.6%) 3/4단계 이상반응 또한 이 약 투여군에서 더 높았다. (13.2 % vs 6.1%) 이 약 투여군에서 간담도 독성으로 인한 용량 조절은 12.3% 이며, 주로 ALT 상승(7.9%) 및 AST 상승(7.3%) 상승이 그 원인이었다. 이 약 군에서 간수치 이상 및 간 독성으로 인한 치료 중단은 각각 2.4%, 0.5% 였다.
‑ QT 연장
조기 유방암 환자를 대상으로 한 3상 임상시험에서 이 약과 아로마타제 억제제 병용군 5.3%, 아로마타제 억제제 단독군 1.4%의 환자에서 QT 간격 연장이 보고되었다. 이 약과 아로마타제 억제제 병용군에서 QT 간격 연장은 주로 ECG QT 연장(4.3%)으로 나타났으며, 이 약과 연관된 것으로 확인된 유일한 이상반응이다. ECG QT 연장 및 실신으로 인한 이 약 일시 중단은 이 약 투여군에서 1.1%의 환자에서 보고되었다. ECG QT 연장으로 인한 용량 조절은 이 약 투여군에서 0.1%의 환자에서 보고되었다.
ECG 자료에 대한 중앙검사실(central) 분석 결과 이 약과 아로마타제 억제제 병용군과 아로마타제 억제제 단독군 각각 10명(0.4%), 4명(0.2%)의 환자가 적어도 한 번 이상 480 ms를 초과하는 post ‑baseline QTcF를 보였다. 이 약과 아로마타제 억제제 병용군에서 QTcF 간격 연장이 480 ms를 초과한 환자들의 발현까지 중앙값은 15일이며, 용량 일시 중단 및/또는 조절을 통해 되돌릴 수 있었다. 베이스라인으로부터 QTcF 간격이 60ms를 초과하는 변화를 보인 환자는 이 약과 아로마타제 억제제 병용군에서 19명(0.8%)이며, post ‑baseline QTcF가 500ms를 초과하는 환자는 이 약과 아로마타제 억제제 병용군에서 3명(0.1%) 이었다.
진행성 또는 전이성 유방암 환자를 대상으로 한 3상 임상시험에서 이 약 투여군의 9.3% 와 위약군의 3.5%의 환자에서 적어도 한 번 이상의 QT 간격 연장이 일어났다. (ECG QT 연장 및 실신 포함) 심전도(ECG) QT 연장 및 실신으로 인한 치료 중단은 이 약 투여군에서 2.9%로 보고되었다.
ECG 자료에 대한 central 분석 결과(평균 3배) 이 약 투여군과 위약군의 각각 55명(5.2%), 12명(1.5%)의 환자가 적어도 한 번 이상 480 msec를 초과하는 post ‑baseline QTcF를 보였다. 이 환자들의 발현까지 중앙값은 15일이며, 병용약제와는 무관하고, 용량 개입 및/또는 조절을 통해 되돌릴 수 있었다.
4. 일반적 주의
1) 간질성 폐질환
간질성 폐질환이 나타날 수 있으므로 이 약 투여 시 초기증상(호흡곤란, 기침, 발열 등) 확인, 흉부X선 검사 실시 등을 통해 환자 상태를 잘 관찰한다. 또한 환자에게 이상사례에 대해 알리고 간질성 폐질환의 초기증상이 나타나는 경우, 즉시 의료기관의 검진을 받도록 안내한다.
5. 상호작용
1) 이 약의 혈장 농도를 증가시킬 수 있는 약물
강력한 CYP3A4 저해제(리토나비르)와의 병용투여는 건강한 시험대상자에서 이 약의 혈장 노출을 3.2배까지 증가시켰다.
생리학적 기반 약동학(PBPK) 시뮬레이션으로 추정하였을 때, 리토나비르(1일 2회 100 mg)와 매일 이 약을 다회 병용 투여 시, 조기유방암 환자에서 이 약(400 mg 1일 1회)의 항정 상태 C<SUB>max</SUB>와 AUC<SUB>0 ‑24h</SUB>는 각각 1.47배, 1.84배 증가하였고, 진행성 또는 전이성 유방암 환자에서는 각각 1.29배, 1.47배 증가하였다. 강력한 CYP3A 저해제(예: 보세프레비르, 클라리트로마이신, 코니밥탄, 자몽 주스, 인디나비르, 이트라코나졸, 케토코나졸, 로피나비르/리토나비르, 네파조돈, 넬피나비르, 포사코나졸, 리토나비르, 사퀴나비르 및 보리코나졸)와의 병용 투여를 피하고 CYP3A를 저해할 가능성이 적은 대체 약물로 병용 투여하는 것을 고려하여야 한다.
이 약 400 mg을 투여하는 조기 유방암 환자에서, 이 약과 강한 CYP3A 저해제를 반드시 병용 투여해야 하는 경우 이상반응을 모니터링하고 필요 시 이 약의 투여용량을 200 mg으로 줄인다.
이 약 600 mg을 투여하는 진행성 또는 전이성 유방암 환자에서 만약 이 약과 강한 CYP3A 저해제를 반드시 병용투여해야 하는 경우, 이 약의 투여 용량을 하루 400 mg로 줄인다.
시토크롬CYP3A 효소를 억제하고 이 약의 혈장 노출을 증가시킬 수 있는 것으로 알려진 자몽이나 자몽 주스의 섭취를 피하는 것이 권장된다.
2) 이 약의 혈장 농도를 감소시킬 수 있는 약물
강력한 CYP3A 유도제(리팜핀)와의 병용투여는 건강한 시험대상자에서 이 약의 혈장 노출을 89%까지 감소시켰다. 강력한 CYP3A 유도제(예: 페니토인, 리팜핀, 카바마제핀, 세인트존스워트 St John’s Wort(Hypericum perforatum))와의 병용 투여를 피하고 CYP3A를 유도할 수 있는 가능성이 최소한이거나 없는 대체 약물과의 병용 투여를 고려해야 한다.
3) 다른 약에 대한 이 약의 효과
미다졸람(민감한 CYP3A4 기질)과 이 약(400 mg)의 다회 투여는 미다졸람 단독 투여에 비해 건강한 시험대상자에서 미다졸람 혈장 노출이 280%(3.80배)증가했다. 임상적으로 연관된 600 mg 용량으로 주어진 이 약은 미다졸람의 AUC를 5.2배 증가시킬 것으로 예측된다.
따라서, 좁은 치료 계수를 가지는 CYP3A 기질과 이 약을 병용 투여할 때는 주의가 필요하다.
이 약이 다음과 같은 약의 혈장 노출을 증가시킬 수 있기 때문에 좁은 치료 계수를 가지는 민감한 CYP3A 기질(알펜타닐, 사이클로스포린, 디히드로에르고타민, 에르고타민, 에베로리무스, 펜타닐, 피모짓, 퀴니딘, 시로리무스, 타크로리무스를 포함하나 이에 국한되지 않음)의 용량 감량이 필요할 수도 있다.
4) 예상되는 상호작용
QT 간격을 연장시키는 약물
이 약과 QT 간격을 연장할 수 있는 가능성이 있다고 알려진 약물(예, 항부정맥 약제)과의 병용 투여를 피한다. 항 부정맥 약제(아미오다론, 디소피라미드, 프로케인아미드, 퀴니딘, 소타롤을 포함하나 이에 국한되지 않음) 및 QT 간격을 연장하는 것으로 알려진 다른 약물(클로로퀸, 할로판트린, 클래리트로마이신, 할로페리돌, 메타돈, 목시플록사신, 베프리딜, 피모짓, 온단세트론을 포함하나 이에 국한되지 않음)과의 병용 투여를 피한다.
6. 임부, 수유부, 가임여성 ◦남성에 대한 투여
1) 임부
⓵ 위험성 요약
동물시험 및 이 약의 작용 기전에 근거할 때, 이 약은 임부에 투여 시 태아에게 유해할 수 있다.
약물 관련 위험성을 알리는 임상 자료는 없다. 동물 생식 독성 시험에서, 이 약을 임신한 동물의 기관형성기에 투여 시, AUC에 근거한 하루 600 mg의 최고 권장 용량에서 사람 노출량의 각각 0.6 또는 1.5배 정도로 랫드에서 착상 후 유산의 발생률 증가와 태아 체중 감소, 토끼에서 태아 기형의 발생률이 증가한다는 결과가 나왔다. 태아에 대한 잠재적 위험성을 임부에게 알려야 한다.
해당 군(indicated population)에서 주요 선천성 기형과 유산의 배경 위험성(background risk)에 대해서는 알려져 있지 않다. 그러나 미국 일반 모집단에서 주요 선천성기형의 배경 위험성 및 유산의 배경 위험성은 임상적으로 인지된 임부의 2 ‑4% 및 15 ‑20%이다.
⓶ 자료
동물 자료: 랫드와 토끼를 대상으로 한 배아 ‑태아 발달 시험에서, 임신한 동물은 기관 형성기에 각각 이 약을 1000 mg/kg/day 또는 60 mg/kg/day 용량으로 경구투여 받았다.
랫드에서, 300 mg/kg/day는 감소된 모체 체중 증가와 태아 저체중과 관련된 골격 변형을 동반한 태아 체중 감소를 가져왔다. 50 mg/kg/day 또는 300 mg/kg/day에서 배아 ‑태아 생존력이나 태아 형태에 유의한 영향은 없었다.
토끼에서 30mg/kg/day 이상 투여 시, 증가한 태아 기형 발생률(기형, 외형, 내장 및 골격 변형)과 태아 성장(태아 저체중)을 포함하여 배아 ‑태아 발달에 있어 유해 효과가 있었다.
이 연구 결과는 축소된/작은 폐엽, 하행 대동맥의 추가 혈관, 대동맥 궁의 추가 혈관, 작은 눈, 횡격막 탈장, 부폐엽의 결손 또는(부분) 폐엽 접합, 축소된/작은 부폐엽, 축소된/ 작은 추가/흔적13 번 갈비뼈, 목뿔뼈의 변형, 치골 목뿔뼈 날개의 구부러짐, 엄지 손가락뼈 수 감소를 포함한다. 배/태자 사망률을 증가시킨다는 증거는 없었다. 30 mg/kg/day에서 모체 독성은 관찰되지 않았다.
랫드에서 300 mg/kg/day, 토끼에서 30 mg/kg/day의 모체 전신 노출량(AUC)은 진행성 또는 전이성 유방암 환자에서의 최고 권장 용량인 600 mg/day으로 노출된 환자의 각각 대략적으로 0.6배와 1.5배 정도였다.
2) 수유부
⓵ 위험성 요약
이 약이 모유 생성 또는 수유한 유아에 미치는 영향에 대한 자료는 없다. 이 약과 이 약의 대사체는 수유한 랫드의 모유로 잘 이행되었다. 이 약으로 인해 수유 중인 유아에게서 중대한 이상 반응의 가능성이 있으므로, 이 약의 투여 기간 및 마지막 용량 투여 후 3주 동안은 수유를 중단하도록 한다.
⓶ 자료
50 mg/kg 단회 용량으로 투여 받은 수유한 랫드에서, 이 약의 노출은 모체 혈장 대비 모유에서 3.56배 높게 나타났다.
3) 가임 여성 및 남성
⓵ 임신 테스트
동물 시험에 근거하여, 이 약은 임부에 투여 시 태아에게 유해한 영향을 미칠 수 있다. 가임 여성은 이 약의 치료를 시작하기 전 임신 테스트를 실시해야 한다.
⓶ 피임(여성)
동물 시험에 근거하여, 이 약은 임부에 투여 시 태아에게 유해한 영향을 미칠 수 있다. 가임 여성은 이 약을 투여하는 동안과 마지막 용량 투여 후 최소 3주 동안은 효과적인 피임법(임신가능성이 1% 미만인 방법)을 사용하도록 한다.
⓷ 수태능(남성)
수컷 생식기조직에 대한 비임상 안전성자료에 근거하면, 이 약의 투여가 남성의 수태능을 약화시킬 수 있다.
7. 소아에 대한 투여
소아 환자에서 이 약의 안전성 및 유효성은 확립되지 않았다.
8. 고령자에 대한 투여
65세 이상의 환자에서 용량 조절은 필요하지 않다.
9. 과량투여시의 처치
사람에 대한 이 약의 과량 투여 경험이 제한적이다. 필요하다면 과량 투여의 모든 경우에 일반적인 증상 및 보조 요법들을 시작해야 한다.
10. 보관 및 취급상의 주의사항
2~8℃에서 냉장 보관한다. 25℃ 미만에서 최대 2개월까지 보관할 수 있다. 원래의 약물 포장 그대로 보관한다.
11. 전문가를 위한 정보
이 약(ribociclib)은 키나아제 억제제이다.
이 약의 화학적 이름은 다음과 같다: Butanedioic acid 7 ‑cyclopentyl ‑N,N ‑dimethyl ‑2 ‑{[5 ‑(piperazin ‑1 ‑yl) pyridin ‑2 ‑yl]amino} ‑7H ‑pyrrolo[2,3 ‑d]pyrimidine ‑6 ‑carboxamide (1/1).
이 약은 밝은 황색에서 황갈색을 띠는 결정형 분말이다. 이 약의 분자식은C<SUB>23</SUB>H<SUB>30</SUB>N<SUB>8</SUB>O ▪C<SUB>4</SUB>H<SUB>6</SUB>O<SUB>4</SUB>이고 분자량은 552.64 g/mol(유리 염기: 434.55 g/mol)이다.
이 약은 경구 제제이고 유리 염기로 리보시클립 200mg을 함유한다(리보시클립 숙신산염 254.40 mg와 동량). 정제는 또한 콜로이드 이산화 규소, 크로스포비돈, 히드록시프로필셀룰로오스, 마그네슘 스테아레이트 및 미결정 셀룰로오스를 함유한다. 필름 코팅은 비활성 물질로 흑색 산화철, 적색 산화철, 레시틴(콩), 폴리 비닐 알코올(부분적으로 가수 분해됨), 탈크, 이산화 티타늄 및 잔탄 검을 함유한다.
1) 임상 약리
⓵ 작용 기전
리보시클립은 사이클린 ‑의존성 키나아제(CDK) 4 및 6의 저해제이다. 이들 키나아제는 D ‑사이클린과 결합하여 활성화되고 세포 주기 진행과 세포 증식을 일으키는 신호전달체계에서 중요한 역할을 한다. 사이클린D ‑CDK4/6 복합체는 망막세포종 단백질(pRb)의 인산화를 통하여 세포 주기 진행을 조절한다.
시험관 내(In vitro)에서, 리보시클립은 pRb의 인산화를 감소시켜 세포 주기를 G1기에 붙잡아두고 유방암 세포주에서 세포 증식 감소를 야기한다. 생체 내(In vivo)에서, 인간 종양 세포를 갖는 랫드 이종 이식 모델에서 리보시클립으로 단일 제제 치료 시 종양 부피가 감소되었으며, 이는 pRb 인산화의 저해와 상관 관계가 있다. 환자 유래 에스트로겐 수용체 양성 유방암 이종 이식 모델을 이용한 연구에서, 리보시클립 및 항에스트로겐(예: 레트로졸)의 병용 투여는 각 약물 단독에 비해 증가한 종양 성장 억제를 입증하였다. 또한, 리보시클립과 풀베스트란트의 병용 투여는 에스트로겐 수용체 양성 유방암 이종 이식 모델에서 종양 성장 억제 결과를 보였다.
⓶ 약력학
(1) 심장 전기생리학:
진행성 암 환자에서 QTcF 간격에 대한 이 약의 영향을 평가하기 위해 단회 투여 후와 항정 상태에서 ECG를 연속 3회 수집했다. 약동학 ‑약력학 분석에는 이 약 50 mg에서 1200 mg 범위 용량으로 치료받은 총 997명의 환자를 포함했다. 분석 결과, 이 약은 농도 의존적으로 QTcF 간격을 증가시킨다.
조기 유방암 환자에서 베이스라인으로부터 QT 간격 변화의 기하 평균은 비스테로이드성 아로마타제 억제제(NSAI)와 이 약 400 mg을 병용 시 항정 상태에서 기하 평균 C<SUB>max</SUB>일 때, 10.00 ms(90% 신뢰구간: 8.0, 11.9)이었다.
진행성 또는 전이성 유방암 환자에서 비스테로이드성 아로마타제 억제제 또는 풀베스트란트와 이 약 600 mg을 병용 투여했을 때 QTcF의 베이스라인으로부터 평균 변화는 각각 22.0 ms(90% 신뢰구간: 20.6, 23.4) 및 23.7 ms(90% 신뢰구간: 22.3, 25.1)이었고, 항정 상태에서 기하학적 평균 C<SUB>max</SUB>는 타목시펜과 병용투여했을 때 34.7 ms(90% 신뢰구간: 31.6, 37.8)이었다.
⓷ 약동학
이 약은 단회 투여와 반복 투여 후에 50 mg에서 1200 mg의 용량 범위에서 노출(혈장 최고 농도(C<SUB>max</SUB>) 및 시간 ‑농도 곡선 하 면적(AUC))에 대해 과도한 비례 증가를 나타냈다. 1일 1번 600 mg으로 반복 투여 후, 항정 상태는 일반적으로 8일 후에 도달하였고, 이 약은 기하 평균 축적비 2.51(범위: 0.972~6.40)로 축적되었다.
(1) 흡수
C<SUB>max</SUB>(T<SUB>max</SUB>)에 도달하는 시간은 이 약 투여 후 1 ‑4시간 사이다.
‑ 음식물의 영향: 공복 상태와 대조하여, 이 약 필름코팅정 600 mg 단회 용량을 고지방 고칼로리 식이(약 800~1000 칼로리, 지방: ~50%, 탄수화물: ~35%, 단백질: ~15%)와 함께 복용했을 때 이 약의 흡수 정도 및 비율에 대해서 영향이 없었다(C<SUB>max </SUB>GMR: 1.00, 90%CI 0.898, 1.11; AUC<SUB>inf </SUB>GMR: 1.06; 90%CI: 1.01, 1.12).
(2) 분포
시험관(in vitro)에서 이 약과 사람 혈장 단백질 결합은 약 70%였고 농도와 무관하였다(10 ‑10,000 ng/mL). 이 약은 적혈구와 혈장 사이에 균등하게 분포되어 있으며 평균 생체 내 혈액 대 혈장 비는 1.04이다. 항정 상태(Vss/F)에서의 겉보기 분포 용적은 집단 PK 분석에 근거하여 1090 L이었다.
(3) 대사
시험관 내(in vitro) 및 생체 내(in vivo) 연구에 따르면, 이 약은 주로 사람에서 CYP3A4를 통해 광범위한 간 대사를 거치는 것으로 나타났다. 사람에게 방사성 표지한 이 약 600 mg 용량 단일 경구 투여 후, 이 약의 주 대사 경로는 산화(탈 알킬화, C 및/또는 N ‑ 산화, 산화( ‑2H)) 및 이들의 조합을 포함했다. 이 약의 1상 대사물질의 2상 결합체는 N ‑아세틸화, 황화, 시스테인 접합, 당화 및 글루크론산화를 포함했다.
약물에서 유래된 혈장 내 주요 순환체는 리보시클립이었다(44%). 주요 순환대사체는 총 방사능의 약 9%, 9% 및 8%과 이 약 노출의 22%, 20%, 18%를 대표하는 대사 산물 M13(CCI284, N ‑히드록실화), M4(LEQ803, N ‑탈메틸화) 및 M1(2차 글루쿠로니드)를 포함했다. 이 약의 임상적 활성(약리학적 및 안전성)은 주로 모체 약물에 기인한 것으로, 순환 대사체의 기여도는 무시할 수 있다.
이 약은 대변과 소변에서 각각 17%와 12%의 미변화체로 광범위하게 대사되었다. 대사체 LEQ803은 배설물에서 주요 대사체였으며, 대변과 소변에서 각각 투여량의 약 14%와 4 %를 나타냈다. 대변과 소변 둘 다에서 소량(투여량의 3% 이하)으로 다수의 다른 대사체가 검출되었다.
(4) 소실
진행성 암 환자에서 600 mg을 투여했을 때 혈장 유효 반감기의 기하 평균(축적비 기준)은 32.0 시간(63% CV)이었고 겉보기 경구 클리어런스(CL / F)의 기하 평균은 항정 상태에서 25.5 L/hr(66% CV)였다. 조기 유방암 환자에서 400mg을 투여했을 때 집단 PK 분석으로 추정한 평균 CL/F는 38.4 L/hr(95%CI 35.5 ‑ 41.9) 였다.
건강한 시험대상자에게 시험 전반에 걸쳐 600 mg을 투여했을 때 리보시클립의 겉보기 혈장 종점 반감기(t<SUB>1/2</SUB>)의 기하 평균은 29.7~54.7 시간 범위에 걸쳐 있었고 리보시클립의 CL/F 기하 평균은 39.9~77.5 L/hr범위였다.
대변은 리보시클립의 주요 배설 경로였고, 소변은 작은 부분을 차지했다. 6명의 건강한 남성 피험자에게 다음의 방사선 표지한 리보시클립을 단회 경구 투여했을 때, 총 투여한 방사능 용량의 92%가 22일 내로 발견되었다. 대변은 배설의 주요 경로였고(69%), 복용량의 23%는 소변에서 발견되었다.
(5) 특정 인구 집단
가. 신장애 환자
경증에서 중등도의 신장애 환자에 있어서 용량 조절은 필요하지 않다. 중증의 신장애 환자에 있어서 권장시작 용량은 1일 1회 200 mg이다.
경증(60 mL/min/1.73m<SUP>2</SUP> ≦ eGFR < 90 mL/min/1.73m<SUP>2</SUP> 및 중등도(30 mL/min/1.73m<SUP>2</SUP> ≦ eGFR < 60 mL/min/1.73m<SUP>2</SUP>)의 신장애는 집단 PK 분석에 근거하여 리보시클립의 노출에 영향을 끼치지 않는다.
정상 신기능(eGFR ≧ 90 mL/min/1.73m<SUP>2</SUP>), 중증 신장애(15 ≦ eGFR < 30mL/min/1.73m<SUP>2</SUP>), 말기 신장질환(ESRD; eGFR < 15 mL/min/1.73 m<SUP>2</SUP>) 을 가진 비 ‑암 환자의 신장애 연구에서 신장애가 리보시클립의 약동학에 미치는 영향을 평가했다. 중증의 신부전증 환자에서 정상 신기능을 가진 환자와 비교하여 AUC<SUB>inf</SUB>는 1.96 배 증가하였고 C<SUB>max</SUB>는 1.51 배 증가했다.
조기 유방암 임상시험(NATALEE) 하위 그룹 PK 분석 데이터에서 이 약 400 mg 반복 투여에 따른 항정 상태에서 경증 또는 중등도 신장애는 리보시클립 노출량에 임상적으로 유의미한 영향을 끼치지 않았다.
나. 간장애 환자
경증의 간장애(Child ‑Pugh class A)환자는 용량 조절이 필요하지 않다. 진행성 또는 전이성 유방암 환자에서, 중등도(Child ‑Pugh class B) 및 중증(Child ‑Pugh class C) 환자에서는 용량 조절이 필요하며 400mg의 시작 용량이 권장된다.
간장애 환자에서 약물 동태 시험 결과, 경증의 간장애(Child ‑Pugh class A)는 리보시클립의 노출에 영향을 미치지 않았다. 리보시클립의 노출 평균은 중등도(Child ‑Pugh class B, 기하 평균 비(GMR): C<SUB>max </SUB>1.44, AUC<SUB>inf </SUB>1.28)와 중증(Child ‑Pugh class C, GMR : C<SUB>max </SUB>1.32, AUC<SUB>inf </SUB>1.29) 환자에서 2배 미만으로 증가했다.
정상적인 간 기능을 가진 160명의 진행성 또는 전이성 암 환자와 경증의 간 장애를 가진 47명의 환자를 포함하는 집단 약동학 분석에서 경증의 간 장애는 리보시클립의 노출에 아무런 영향을 끼치지 않았고, 간 기능 장애 연구 결과를 추가적으로 뒷받침했다.
다. 연령, 체중, 성별, 인종 영향
리보시클립의 전신 노출에 있어서 연령, 체중, 성별, 또는 인종은 임상적으로 관련 있는 영향을 주지 않는 것으로 집단 약동학 분석은 밝혔다.
라. 고령자에 대한 투여
조기 유방암 환자를 대상으로 한 3상 임상시험(NATALEE)에서 이 약을 투여 받은 2549명의 환자 중 407명의 환자(16.0%)가 만 65세 이상이었다.
진행성 또는 전이성 유방암 환자를 대상으로 한 임상시험(MONALEESA ‑2, 리보시클립+ 레트로졸군)에서 이 약을 투여 받은 334명의 환자 중 150명의 환자(45%)가 만 65세 이상, 35명의 환자(11%)가 만 75세 이상이었다. 임상시험 MONALEESA ‑3에서 이 약을 투여 받은 484명의 환자 중 226명(47%)이 만 65세 이상이었고 65명(14%)이 만 75세 이상이었다. 이 약의 안전성 및 유효성에서 고령자와 젊은 환자 간 차이는 전반적으로 없었다.
(6) 약물 상호 작용 연구
‑ CYP3A 저해제: 건강한 시험대상자에 대한 약물 상호 작용 시험은 리토나비르(강력한 CYP3A 저해제)를 사용하여 수행되었다. 리보시클립 단독 투여에 비해 리토나비르(100 mg 2 회/일, 14일간)는 400 mg 리보시클립 단회 투여 후 리보시클립의 C<SUB>max</SUB>와 AUC<SUB>inf</SUB>를 각각 1.7배와 3.2배 증가시켰다. LEQ803(모체 노출의 10% 미만을 차지하는 리보시클립(LEE011)의 현저한 대사체)에 대한 C<SUB>max</SUB> 및 AUC는 각각 96% 및 98% 감소했다.
생리학적 기반 약동학(PBPK) 시뮬레이션에서 리토나비르(1일 2회 100 mg)과 병용 시 암 환자에서 리보시클립(1일 1회 400 mg) 정상 상태의 C<SUB>max</SUB>와 AUC<SUB>0 ‑24h</SUB>가 조기 유방암 환자에서 각각 1.47, 1.84배 증가하였고 진행성 또는 전이성 유방암 환자에서 1.29, 1.47배 증가하였다.
PBPK 시뮬레이션에 따르면 중등도의 CYP3A4 저해제(에리스로마이신)는 리보시클립 400 mg 항정 상태의 C<SUB>max</SUB> 및 AUC를 조기 유방암 환자에서 각각 1.13배 및 1.23배, 진행성 또는 전이성 유방암 환자에서 각각 1.08배 및 1.13배 증가시킬 것으로 예상된다.
‑ CYP3A 유도제: 건강한 시험대상자에서의 약물 상호 작용 시험은 리팜피신(강력한CYP3A4 유도제)으로 수행되었다. 리보시클립 단독 투여에 비해 리팜피신(매일 600mg, 14 일간)은 600 mg의 단일 리보시클립 투여 후 리보시클립의 C<SUB>max</SUB>와 AUC<SUB>inf</SUB>를 각각 81%와 89% 감소시켰다. LEQ803 C<SUB>max</SUB>는 1.7배 증가하였고, AUC<SUB>inf</SUB>는 27% 감소했다.
PBPK 시뮬레이션에 따르면 중등도의 CYP3A 유도제(에파비렌즈)는 리보시클립 단회 투여 시 C<SUB>max</SUB>와 AUC를 조기 유방암 환자에서 각각 45% 및 69%, 진행성 또는 전이성 유방암 환자에서 각각 37% 및 60% 감소시킬 것으로 예상된다.
‑ 시토크롬 P450효소(CYP3A4와 CYP1A2)기질: 건강한 시험대상자에서 약물 상호 작용 시험은 미다졸람(민감한 CYP3A4 기질)과 카페인(민감한 CYP1A2 기질)을 사용한 칵테일 연구로 수행되었다. 미다졸람과 카페인 단독 투여에 비해 리보시클립을 다회(400 mg 1일 1회, 8일간) 투여하면 미다졸람의 C<SUB>max</SUB>와 AUC<SUB>inf</SUB>가 각각 2.1배와 3.8배 증가했다. 1일 1회 리보시클립 600 mg의 투여는 미다졸람의 C<SUB>max</SUB>와 AUC를 각각 2.4배와 5.2배 증가시킬 것으로 예상된다. 카페인에 대한 리보시클립 다회 투여 효과는 적으며, 10% 감소한 C<SUB>max</SUB>와 20% 증가한 AUC<SUB>inf</SUB>를 보였다. 리보시클립 1일 1회 600 mg 용량에서 CYP1A2 기질에 대한 약한 저해 작용이 예상된다.
시험관 내에서, 리보시클립은 임상적으로 연관된 농도에서 CYP1A2, CYP2E1 및CYP3A4/5의 가역적 저해제 및 CYP3A4/5의 시간 의존적 저해제였다. 시험관 내 평가 결과는 이 약이 임상적으로 연관된 농도에서 CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19 및 CYP2D6의 활성을 억제할 잠재력을 가지고 있지 않음을 시사했다. 임상적으로 연관된 농도에서 CYP1A2, CYP2C9 및 CYP2D6의 시간 의존적 저해 가능성 및 CYP1A2, CYP2B6, CYP2C9 및 CYP3A4의 유도 가능성은 없다.
‑ 위pH 상승 약물: 위산pH를 상승시키는 약물과 리보시클립의 병용 투여는 임상 시험에서 평가되지 않았다. 그러나, 변화한 리보시클립 흡수는 집단 PK 분석에서 확인되지 않았고, 생리학 기반 PK 모델을 사용하여 예측되지 않았다.
‑ 레트로졸: 유방암 환자에 대한 임상시험 자료와 집단 PK 분석에 따르면 리보시클립과 레트로졸 병용투여 시 두 약물 간 상호 작용은 없었다.
‑ 엑스메스테인: 유방암 환자에 대한 임상시험 자료에 따르면 리보시클립과 엑스메스테인 병용투여 시 두 약물 간 상호 작용은 없었다.
‑ 아나스트로졸: 유방암 환자에 대한 임상시험 자료에 따르면 리보시클립과 아나스트로졸 병용투여 시 두 약물 간 상호 작용은 없었다.
‑ 풀베스트란트: 유방암 환자에 대한 임상시험 자료에 따르면 리보시클립과 풀베스트란트 병용투여 시 리보시클립의 노출에 대한 풀베스트란트의 임상적으로 연관된 효과는 없었다.
‑ 타목시펜: 이 약은 타목시펜과 병용투여에 관한 적응증이 없다. 유방암 환자에 대한 임상시험 자료에 따르면 타목시펜의 C<SUB>max</SUB>와 AUC는 리보시클립 600 mg 병용 투여 후 약 2배 정도로 증가했다.
‑ 전달체(Transporters)에 대한 리보시클립의 효과: 시험관 내 평가는 이 약이 임상적으로 연관된 농도에서 약물 전달체 P 당단백질(P ‑gp), 유기 음이온 전달 폴리펩티드(OATP1B1 / B3), 유기 음이온 수송체(OCT1), MATEK2의 활성을 저해할 가능성이 낮음을 보여 주었다. 이 약은 유방암 저항성 단백질(BCRP), 유기 양이온 전달체(OCT2), MATE1 및 인간 BSEP를 임상적으로 연관된 농도에서 저해할 수 있다.
‑ 리보시클립에 대한 전달체의 효과: 시험관 내 자료에 따르면, P ‑gp 및 BCRP 매개 전달은 치료용량에서의 리보시클립 경구 흡수 정도에 영향을 미칠 가능성이 낮다. 리보시클립은 시험관 내에서 간 흡수 전달체 OARP1B1/1B3 또는 OCT ‑1의 기질이 아니다.
2) 비임상 독성학
⓵ 발암성, 돌연변이 유발, 수태능 장애
2년간의 랫드를 대상으로 한 시험에서 리보시클립의 발암성이 평가되었다. 2년간 리보시클립을 경구 투여한 결과, > 300 mg/kg/day를 투여한 암컷 랫드에서 상피성 자궁내막암 및 자궁, 자궁경부 편평세포 과증식 발생률이 증가하였으며, 50 mg/kg/day를 투여한 수컷 랫드에서 갑상샘 소낭 종양 발생률이 증가하였다. 종양 변화가 나타난 암컷 및 수컷 랫드의 항정 상태(AUC<SUB>0 ‑24h</SUB>)에서 평균 노출량은, 600 mg/day의 권장 용량을 투약한 환자보다 각각 1.2, 1.4배 였다. 종양 변화가 나타난 암컷 및 수컷 랫드의 항정 상태(AUC<SUB>0 ‑24h</SUB>)에서 평균 노출량은, 400 mg/day를 투약한 환자보다 각각 2.2, 2.5배 였다. 비 종양성, 증식성의 변화로는 각각 ≧ 5 mg/kg/day 및 50 mg/kg/day를 투여한 수컷 랫드에서 간의 변환 병소(호염기세포, 투명세포) 증가, 정소 간질 세포(레이디세포) 과증식이었다. 자궁/자궁경부 및 정소 간질 세포(레이디세포)에 대한 영향은 CDK4 저해에 따른 뇌하수체 프로락틴 분비 세포 기능 저하 및 그에 따라 지속되는 저프로락틴혈증(hypoprolactinemia)으로 인한 시상하부 ‑뇌하수체 ‑생식선 축의 변화와 관련이 있을 수 있다. 수컷의 갑상샘 결과에 대한 가능한 기전은, 간의 설치류 특이적 미소체 효소 유도 및/또는 지속적인 저 프로락틴 혈증에 따른 시상하부 ‑뇌하수체 ‑생식선 축의 조절 장애를 포함한다. 프로락틴 합성 및 역할에 대한 설치류와 사람 간의 차이점을 고려하였을 때, 이 작용기전은 사람에게서 동일한 결과를 보이지 않을 것으로 예측된다.
리보시클립은 시험관 내 세균 복귀 돌연변이 분석법(Ames assay)에서 돌연변이 유발성이 아니었고, 시험관 내 인간 림프구 염색체 변형 분석법 또는 생체 내 랫드 골수 미세핵 분석법에서 염색체 이상 유발성이 아니었다.
수태능 및 초기 배아 발달 연구에서, 암컷 랫드는 임신 첫 주까지 교미하기 앞서 14 일 동안 리보시클립을 경구 투여 받았다. 리보시클립은 최대 300 mg/kg/day(AUC 기준 600 mg/day의 최고 권장 용량에서 환자의 임상적 노출량의 약 0.6배)까지 생식 기능, 수태능 또는 초기 배아 발달에 영향을 미치지 않았다.
수컷 랫드에서 리보시클립의 수태능 연구는 수행되지 않았다. 랫드에서 최대 26주, 개에서 최대 39주간 리보시클립을 매일 경구 투여로 3주간 투약/1주 휴약 하는 반복 투여 독성 시험에서 고환의 위축성 변화가 보고되었다. 연구 결과는 랫드와 개에서 고환 정세관 상피의 퇴화, 정액저하증 및 부고환에서 관강내 세포 잔해를 포함하고, 랫드에서 부고환의 상피 세포 공포화를 포함한다. 이러한 결과는 랫드의 경우 75 mg/kg 이상, 개의 경우 1 mg/kg 이상에서 관찰되었는데 AUC 기준으로 권장 최고 일일 투여량 600 mg/day인 인간 노출량의 각각 1.4배와 0.03배인 전신 노출 결과를 나타냈다. 이러한 효과는 정세관의 위축을 초래하는 고환 생식 세포에 대한 직접적인 항 증식 효과와 관련될 수 있으며 4주간 비 ‑투여 기간 후 랫드 및 개에서 가역적인 경향을 보여주었다.
⓶ 동물 독성 및/또는 약리학
개를 대상으로 한 생체 내 심장 안전성 시험에서 600 mg의 권장 용량을 받는 환자와 유사한 노출 수준에서 QTc 간격 연장과 관련된 용량 및 농도가 입증되었다. 상승한 노출량(예상되는 임상 C<SUB>max</SUB>의 약 5배)에서 조기 심실 수축(PVC) 발생을 유발할 가능성이 있다.
3) 임상 시험
⓵ NATALEE(CLEE011O1201C)
이 약은 호르몬 수용체(HR) ‑양성, 사람 상피 세포 성장인자 수용체2(HER2) ‑음성, 림프절 상태와 관계없이 재발 위험이 높은 해부 병기 Ⅱ 또는 Ⅲ기의 조기 유방암이 있는 폐경 전/후 여성 및 남성에서 이 약과 아로마타제 억제제(AI, 레트로졸 또는 아나스트로졸) 병용 또는 아로마타제 억제제 단독의 무작위배정, 공개, 다기관 3상 임상시험을 통해 평가되었다. 임상시험에는 해부 병기 IIA, IIB ‑ III기 환자가 포함되었는데, IIA기 환자는 림프절 침범이 있거나 림프절 침범(nodal involvement)이 없을 경우 높은 위험성의 유전적 프로파일 또는 Ki67 ≧ 20%를 가진 2등급이나 3등급인 경우에만 포함되었다.
폐경 전 여성 및 남성은 또한 고세렐린을 투여 받았다. TNM 분류법을 적용하여 NATALEE 임상시험은 모든 림프절 침범(lymph node involvement)이 있는 환자를 포함하였으며, 림프절 침범이 없을 경우 종양 사이즈 > 5 cm 또는 종양 사이즈 2 ‑5 cm 및 2등급(높은 위험성의 유전적 프로파일 또는 Ki67 ≧ 20%) 또는 3등급인 환자를 포함하였다.
20명의 남성 환자를 포함한 총 5,101명의 환자가 이 약 400 mg + 아로마타제 억제제 병용군(n = 2,549) 또는 아로마타제 억제제 단독군(n = 2,552)으로 1:1의 비율로 각각 무작위 배정되었다. 무작위 배정은 해부 병기(Ⅱ기 [n = 2,154(42.2%)] vs III기 [n = 2,947(57.8%)]), 이전 치료(보조/신보조 화학요법 (유[n = 4,432(86.9%)] vs 무[n = 669(13.1%)], 폐경기 상태(폐경 전 여성 및 남성[n = 2,253(44.2%)] vs 폐경 후 여성[n = 2,848(55.8%))) 그리고 지역(북아메리카, 서부유럽, 오세아니아[n = 3,128(61.3%)] vs 그 외 지역[n = 1,973(38.7%)]에 따라 층화되었다.
이 약은 21일간 하루 400 mg 경구 투여 후 7일간 휴약기를 가졌으며, 레트로졸 2.5 mg 또는 아나스트로졸 1 mg을 28일간 경구 병용하였다. 고세렐린은 28일 주기의 1일차에 3.6 mg을 피하로 투여하였다. 이 약의 치료는 무작위 배정된 날로부터 3년 동안 지속되었다(대략 39 주기).
등록한 환자들 나이의 중앙값은 52세(24세부터 90세)였다. 15.2%의 환자가 65세 이상, 그 중 123명(2.4%)의 환자는 75세 이상이었다. 포함된 환자들은 백인(73.4%), 아시아인(13.2%), 흑인 또는 아프리카계 미국인(1.7%)였다. 모든 환자들의 ECOG 수행 상태는 0 또는 1이었다. 임상시험에 참여 하기 전 88.1%의 환자가 보조요법 또는 신 보조요법 단계에서 항암 화학요법을 받았고, 71.1%의 환자가 항호르몬 요법을 받았다.
NATALEE 임상시험의 일차 평가 변수는 침습적 무질병 생존률(invasive disease free ‑survival, iDFS) 이다.
iDFS는 무작위 배정부터 국소 침습성 유방암 재발, 구역 침습성 유방암 재발, 원격 재발, 반대쪽의 침습성 유방암, 이차 원발성 비 ‑유방 침습성 종양(피부의 기저세포암 및 편평세포암 제외)의 첫 번째 발생 또는 모든 원인에 의한 사망까지 걸린 시간으로 정의되었다.
일차 iDFS 분석(마감일 2023년 1월 11일)에서, iDFS는 이 약과 아로마타제 억제제 병용군에서 아로마타제 억제제 단독군 보다 (HR 0.748, 95% CI 0.618, 0.906; 단측 층화 로그 순위 검정 p=0.0014) 통계적으로 유의하게 개선되었다.
약 6.3개월의 추가적인 추적 기간을 거친 최종 iDFS 분석 결과(마감일 2023년 7월 21일)는 아래 [표12], [그림1]와 같다. 최종 iDFS 분석 시점에서 치료 기간의 중간값은 약 30개월이었으며, iDFS 추적 관찰 기간의 중간값은 33.3개월이었다.
무재발 생존률(recurrence free survival, RFS)은 이 약 + 아로마타제 억제제 병용군에서 7.5%(192명), 아로마타제 억제제 단독군에서 9.7%(248명)였다(HR 0.727, 95%CI 0.602, 0.877)). 원격 무전이 생존률(distant disease ‑free survival, DDFS)은 이 약 + 아로마타제 억제제 병용군에서 8%(204명), 아로마타제 억제제 단독군에서 10%(256명)였다(HR 0.749, 95%CI 0.623, 0.900).
최종 iDFS 분석 시점 기준 전체 사망자 수는 172명(3.5%)으로, 전체 생존기간을 평가할 수준에 도달하지 않았다.
[표12]. NATALEE(O12301C) 최종 유효성 결과(iDFS, 시험자 평가, 모든 분석 대상자군)
|
|
이 약+AI* N=2549 |
AI N=2552 |
|
침습적 무질병 생존률(iDFS)a | ||
|
사건이 있는 환자의 비율(n, %) |
226 (8.9%) |
283 (11.1%) |
|
위험비(95% CI) |
0.749 (0.628, 0.892) | |
|
p 값b |
0.0006 | |
|
36개월에서 iDFS(%, 95% CI) |
90.7 (89.3, 91.8) |
87.6 (86.1, 88.9) |
|
CI = 신뢰구간, N = 환자수 aiDFS: iDFS는 무작위 배정부터 다음 사건의 첫 발생까지 걸린 시간:국소/구역 재발, 원격 재발, 반대쪽의 침습성 유방암, 이차 원발성 비 - 유방 침습적 종양 또는 모든 원인에 의한 사망 b명목p-값은 단측 층화 로그 순위 검정을 통해 얻어진 값이다 *레트로졸 또는 아나스트로졸 | ||
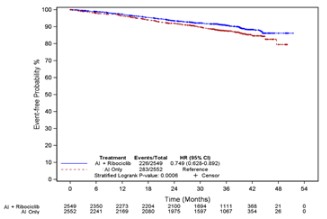
AI ‑ 아로마타제 억제제
p ‑값은 단측 층화 로그 순위 검정을 통해 얻어진 값이다.
⓶ MONALEESA ‑2: 레트로졸과 이 약의 병용
호르몬 수용체(HR) ‑양성 및 사람상피세포 성장인자수용체2(HER2) ‑음성인 진행성 또는 전이성 유방암을 가진 폐경 후 여성에서의 일차 내분비 요법
이 약은 호르몬 수용체(HR) ‑양성 및 사람상피세포 성장인자수용체2(HER2) ‑음성인 진행성 또는 전이성 유방암을 가진 폐경 후 여성에서 일차 요법으로 투여된 레트로졸+ 이 약 또는 레트로졸 단독의 무작위배정, 이중맹검, 위약대조, 다기관3상 임상 시험을 통해 평가되었다.
총668 명의 환자가 간 또는 폐의 전이 유무에 따라(전이된 경우n=292(44%), 전이 되지 않은 경우n =376 (56%)) 층화되어1:1의 비율로 이 약600mg + 레트로졸(n=334) 또는 위약+ 레트로졸 (n=334) 로 각각 무작위 배정되었다. 인구 통계학 및 베이스라인 질병 특성은 각 군이 균형을 이루었고 비교 가능하다. 이 약은21일간 하루600mg 경구 투여 후7일간 휴약기를 가졌으며, 레트로졸은 하루2.5mg, 28일간 병용하였다. 시험 도중 또는 질병의 진행 후에 위약군에서 이 약 투여군으로의 변경은 허용되지 않았다.
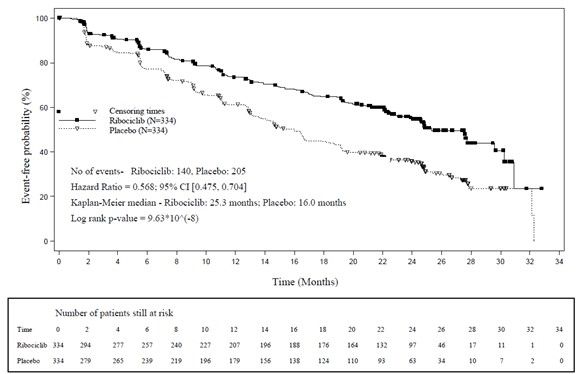
등록한 환자들 나이의 중앙값은62세(23세부터91세) 이었으며44.2 %의 환자들이65세 이상, 그 중69 명의 환자들은75세 이상이었다. 포함된 환자들은 백인(82.2%), 아시아인(7.6%), 흑인(2.5%) 이었다. 모든 환자들의ECOG 수행 상태는0점 또는1점이었다. 임상시험에 참여하기 전43.7 %의 환자가 보조요법 또는 신 보조요법 단계에서 항암화학요법을 받았고, 52.4%의 환자는 항호르몬요법을 받았다. 34.1 %의 환자는 첫 치료였다. 20.7%의 환자는 뼈 질환을 앓았으며59.0%의 환자는 내장 질환을 앓고 있었다. 이전(신)보조 요법에서 아나스트로졸 또는 레트로졸 치료를 받은 환자들은, 무작위 배정12개월 전에 이 치료가 끝났어야 했다. 임상 시험의 일차평가변수는 고형암에서 반응 평가 기준(Response Evaluation Criteria in Solid Tumors, RECIST) 버전1.1을 이용하여 모든 환자군을 대상으로 한 시험자의 평가를 바탕으로 무진행 생존기간(PFS) 목표치의80%에 도달한 이후 계획된 중간분석이며, 독립적인 중앙, 맹검의 방사성 평가를 통해 확인되었다. 유효성 결과에서 이 약+ 레트로졸 투약군을 위약+ 레트로졸 투약군과 비교한 모든 분석 대상자군에서 무진행 생존기간이 통계학적으로 의미있게 향상되었으며, 의미있는 치료 효과를 보였다. (위험비0.556, 95% CI: 0.429, 0.720, 단측 층화 로그 순위 검정p ‑값0.00000329)
전반적인 건강 상태/ 삶의 질 에서는 이 약+ 레트로졸 투여군과 위약+ 레트로졸 투여군에서 의미있는 차이를 보이지 않았다. 더 업데이트된 유효성 자료(2017. 01. 02 기준)는 [표13], [표14]에나타나있다.
무진행 생존기간의 중앙값은 리보시클립+ 레트로졸 투약군에서25.3 개월(95% CI: 23.0, 30.3), 위약+ 레트로졸 투여군에서16.0 개월(95% CI: 13.4, 18.2) 이었으며 리보시클립+ 레트로졸 투여군의54.7%의 환자가24개월 동안 무진행이었던 것에 반해 위약+ 레트로졸 투여군은35.9% 였다.
[표13].MONALEESA ‑2 일차 유효성 결과: 무진행 생존기간(PFS) (2017년1월2일cut off)
|
|
이 약+레트로졸 N=334 |
위약+레트로졸 N=334 |
|
무진행 생존기간 | ||
|
중간값(개월수) (95% CI) |
25.3(23.0-30.3) |
16.0(13.4-18.2%) |
|
위험비(95% CI) |
0.568(0.457-0.704) | |
|
p-값* |
9.63×10-8 | |
|
CI = 신뢰구간, N = 환자수 *p-값은 단측 층화 로그 순위 검정을 통해 얻어진 값이다. | ||
[표14]. MONALEESA ‑2 유효성 결과: ORR, CBR (2017년1월2일cut off)
|
분석 |
이약+ 레트로졸 (%, 95% CI) |
위약+ 레트로졸 (%, 95% CI) |
p-값c |
|
모든 분석 대상자군 |
N=334 |
N=334 |
|
|
전체 반응률(ORR)a |
42.5(37.2,47.8) |
28.7(23.9,33.6) |
9.18 ×10-5 |
|
임상적 이점 비율(CBR)b |
79.9(75.6,84.2) |
73.1(68.3,77.8) |
0.018 |
|
측정 가능한 질환 가진 환자 |
N=257 |
N=245 |
|
|
전체 반응률 (ORR) |
54.5(48.4,60.6) |
38.8(32.7,44.9) |
2.54 × 10-4 |
|
임상적 이점 비율(CBR) |
80.2(75.3,85.0) |
71.8(66.2,77.5) |
0.018 |
|
a전체반응률(ORR, Overall response rate) = 완전 관해 및 부분 관해를 보인 환자의 비율 b임상적 이점 비율(CBR, clinical benefit rate) = 완전 관해를 보인 환자+ 부분 관해(+ 안정 병변 혹은 불완전반응/질환 무진행24주 이상) 보인 환자의 비율 cp-값은 단측Cochran-Mantel_Haenszel 카이 스퀘어 테스트를 통해 얻어졌다. | |||
최종OS 분석
최종 전체 생존률 분석(2021년6월10일)의 시점에서, 해당 임상시험은 주요 이차 평가 변수에 도달하였으며, 사망 위험성에 대해 상대적으로23.5%가 감소함으로서, 통계적으로 유의하고, 임상적으로 유 의미한 최종 생존률의 향상을 보였다. (HR: 0.765, 95% CI: 0.628, 0.932, p=0.004)
최종 전체 생존률에 관한 이익은 시간이 지날수록 증가하였으며, 6년간 생존률은 이 약 투여군에서44.2%(38.5, 49.8), 위약 투여군에서32.0%(26.8, 37.3) 이었다. 최종 전체 생존률 중앙값은 이 약 투여군에서63.9 개월(95% CI : 52.4, 71.0), 위약 투여군에서51.4개월(95% CI: 47.2, 59.7)이었으며, 이 약 투여군에서 최종 생존률 중앙값이12.5 개월 향상됨을 보였다.
하위군 분석에서 탐색적 최종 전체 생존률 결과 분석에 따르면, 이전의 보조요법 또는 선행요법의 화학치료 및 호르몬 치료, 간 및/또는 폐의 연관성, 뼈로만의 전이의 환자 하위 그룹에서 일관되었다.
[표15]. MONALEESA ‑2 유효성 결과(전체 생존률) (2021년6월10일cut ‑off)
|
전체 생존률, 전체 시험 대상자군 |
이 약600mg + 레트로졸 N=334 |
위약+레트로졸 N=334 |
|
사건n(%) |
181 (54.2) |
219 (65.6) |
|
전체 생존률 중앙값(개월,95% CI) |
63.9 (52.4, 71.0) |
51.4 (47.2, 59.7) |
|
위험비(95% CI)a |
0.765 (0.628, 0.932) | |
|
p 값b |
0.004 | |
|
전체 생존률 무사건 비율(%) (95% CI) |
| |
|
24 개월 |
86.6 (82.3, 89.9) |
85.0 (80.5, 88.4) |
|
60 개월 |
52.3 (46.5, 57.7) |
43.9 (38.3, 49.4) |
|
72 개월 |
44.2 (38.5, 49.8) |
32.0 (26.8, 37.3) |
|
CI : 신뢰구간 a 위험비는 층화된Cox PH 모델을 통해 얻어진 값이다. b p-값은IRT에 따른 간 및/또는 폐 전이의 유무에 대한 단측 층화 로그 순위 검정을 통해 얻어진 값이다. | ||
[그림3]. MONALEESA ‑2: 전체 생존률에 대한 카플란 ‑마이어그래프(모든 분석 대상자군)(2021년6월10일data ‑ cut off)
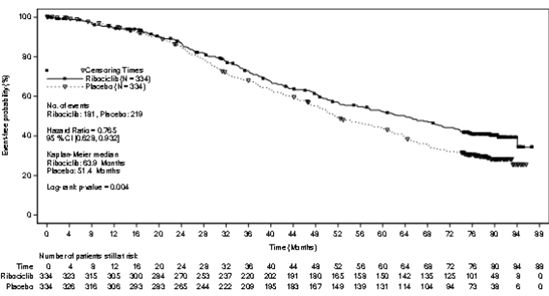
단측P 값은 층화된 로그 순위 검정을 통해 얻어졌다.
그 이후의 화학요법까지의 중앙값은 이 약 투여군에서 위약군과 비교하여11.7 개월 연장되었다. (이 약 투여군: 50.6개월, 95% CI: 38.9, 60.0 개월/ 위약군: 38.9 개월, 95% CI: 31.4, 45.4). 화학요법 필요의 가능성은 이 약 투여군에서 위약군과 비교하여25.8% 감소하였다.(HR: 0.742; 95% CI: 0.606, 0.909)
⓷ MONALEESA ‑7: 아로마타제 저해제와 이 약의 병용
(호르몬 수용체(HR) ‑양성 및 사람상피세포 성장인자수용체2(HER2) ‑음성인 진행성 또는 전이성 유방암을 가진 폐경 전/이행기 환자에서의 일차 내분비 요법)
임상 시험MONALEESA ‑7은 진행성 질병에 대해 이전에 내분비 요법을 받은 적이 없는 호르몬 수용체(HR) ‑양성 및 사람상피세포 성장인자수용체2(HER2) ‑음성인 진행성 유방암 가진 폐경 전/이행기 여성에서 수행된 이 약+비스테로이드성 아로마타제 저해제(NSAI) 또는 타목시펜+고세렐린vs 위약+NSAI 또는 타목시펜+고세렐린의 무작위 배정, 이중 맹검, 위약 대조 시험이다.
총672명의 환자가 이 약+NSAI 또는 타목시펜+고세렐린(n=335) 또는 위약+NSAI 또는 타목시펜+고세렐린(n=337)로 무작위 배정되었으며 간 및/또는 폐 전이의 유무, 진행성 질환에 대한 이전 항암 화학요법, 내분비 조합 파트너(타목시펜+고세렐린vs NSAI+고세렐린)에 따라 층화되었다. NSAI(레트로졸2.5mg 또는 아나스트로졸1mg) 또는 타목시펜20mg는 연속적인 일일 일정에 따라 하루 한번 경구로 투여 받았고, 고세렐린은 피하주사로28일 주기 중 첫날에 투여 받았으며, 이 약600mg 또는 위약은 질병이 진행되거나 받아들이기 어려운 독성이 나타날 때까지21일 연속으로 하루 한번 경구 투여하고7일 간의 휴약 기간을 가졌다. 임상 시험의 주요 유효성 결과 측정은 고형암에서 반응 평가 기준(Response Evaluation Criteria in Solid Tumor, RECIST) 버전1.1을 이용한 시험자 평가 무진행 생존 기간(PFS)이었다.
임상시험MONALEESA ‑7에 등록한 환자의 연령 중앙값은44세(범위: 25~58세)였고 주로 백인(57.7%), 동양인(29.5%), 흑인(2.8%)이었다. 거의 모든 환자들(99.0%)의ECOG 수행 상태는0점 또는1점이었다. 672명의 환자 중32.6%가 보조 요법에서 항암화학요법을 받은 것에 비해18.0%에서 신 보조요법으로 항암화학요법을 받았고, 임상 시험 시작 전에39.6%는 보조 요법에서 내분비 요법을, 0.7%는 신 보조요법에서 내분비 요법을 받았다.
40.2%의 환자는 신생 전이 질환을 앓았고, 23.7%는 뼈 질환을 앓았으며, 56.7%는 내장 질환을 앓고 있었다. 인구 통계학 및 베이스라인 질병 특성은 임상 시험 군과 내분비 조합 파트너 간에 균형을 이루고 비교 가능하다.
이 시험의 일차 평가 변수는 고형암에서 반응 평가 기준(Response Evaluation Criteria in Sold Tumor, RECIST) 버전1.1을 통한318 건의 무진행 생존기간을 관찰함으로서 도달하였다. 이는 모든 분석 대상자군에 대한 시험자 평가를 기반으로 하며, 일차 유효성 결과는 맹검독립검토위원회(BIRC, Blinded independent review committee)를 통해 확립되었다. 일차 무진행 생존기간 분석 시점에서 추적기간의 중앙값은19.2 개월이다.
전체 시험 대상자군에서, 유효성 결과는 이 약+ NSAI/타목시펜+ 고세렐린 투여군에서 위약+ NSAI/타목시펜+고세렐린과 비교하여 통계적으로 현저히 향상된 결과를 보였으며, [HR 0.553(95% CI: 0.441, 0.694); 단측 층화 로그 순위 검정p ‑값9.83 x 10 ‑8]임상적으로 의미 있는 치료 효과를 보였다. 무진행 생존기간의 중앙값(95% CI) 은 이 약+ NSAI/타목시펜+고세렐린 투여군에서23.8개월(19.2, NE), 위약+ NSAI/타목시펜+ 고세렐린 투여군에서13.0개월(11.0 16.4) 이었다. 유효성 결과는 [그림4]에요약되어있다.
[그림4].MONALEESA ‑7: 무진행 생존기간에 대한 카플란 ‑마이어그래프(시험자평가, 모든 분석 대상자군)(2017년8월20일cut off)
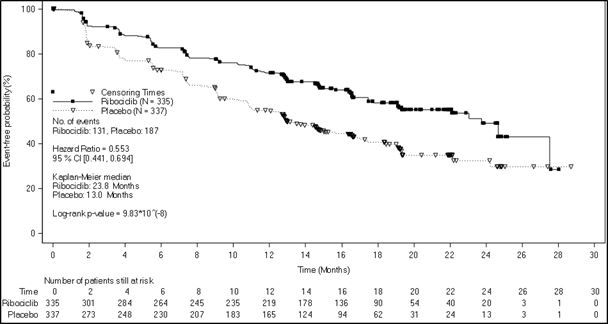
일차 무진행 생존 기간 분석 시점에서, 전체 생존률 데이터는 완성되지 않았으며, 89건(13%)의 사망이 발생하였다. (HR 0. 916 [95% CI: 0.601, 1.396]).
RECIST 버전1.1에 근거한 시험자 평가에 따른 전체 반응률은 이 약 투여군(40.9%; 95%CI: 35.6, 46.2)에서 위약 투여군보다(29.7% 95% CI: 24.8, 34.6; p=0.00098) 높았다. 임상적 이점 비율(overall clinical benefit rate, CBR)은 이 약 투여군(79.1%; 95% CI: 74.8:83.5)에서 위약 투여군보다(69.7%; 95% CI: 64.8:74.6 p=0.002) 높았다.
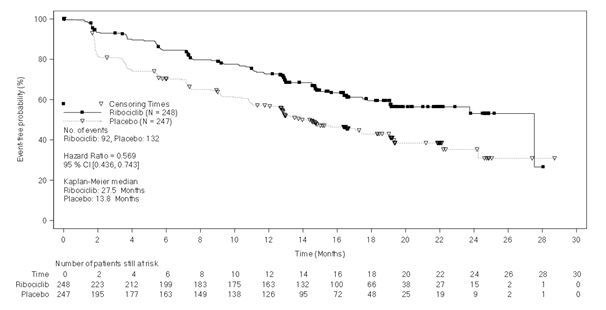
이 약 또는 위약과NSAI+고세렐린을 투여 받은495명의 환자를 대상으로 한 전 ‑특성화 하위군 분석으로부터 무진행 생존기간(95% CI) 은 이 약+NSAI 하위군에서27.5 개월(19.1 NE), 위약+NSAI 하위군에서13.8개월(12.6, 17.4) [HR: 0.569 (95% CI: 0.436, 0.743)] 이었다. 유효성 결과는 [표16] 및 [그림5]에요약되어있다.
[표16]: MONALEESA ‑7: 유효성 결과(NSAI, 시험자 평가) (2017년08월20일cut off)
|
|
이 약+NSAI+고세렐린 N=248 |
위약+NSAI+고세렐린 N=247 |
|
무진행 생존기간 |
| |
|
중앙값(개월, 95% CI) |
27.5(19.1, NE) |
13.8(12.6, 17.4) |
|
위험비(95% CI) |
0.569(0.436-0.743) | |
|
NE = not estimable 무진행생존기간은, 시험자 방사선학 평가를 기반으로 하였다. | ||
[그림5]. MONALEESA ‑7: 무진행 생존기간에 대한 카플란 ‑마이어 그래프 ‑ (NSAI, 시험자평가) (2017년08월20일cut off)
[표17]. MONALEESA ‑7 유효성 결과: ORR, CBR (NSAI, 시험자평가) (2017년8월20일cut off)
|
분석 |
이약+ NSAI+ 고세렐린 (%, 95% CI) |
위약+ NSAI+고세렐린 (%, 95% CI) |
|
모든 분석 대상자군 |
N=248 |
N=247 |
|
전체 반응률(ORR)a |
39.1 (33.0, 45.2) |
29.1 (23.5, 34.8) |
|
임상적 이점 비율(CBR)b |
80.2 (75.3, 85.2) |
67.2 (61.4, 73.1) |
|
측정 가능한 질환 가진 환자 |
N=192 |
N=199 |
|
전체 반응률 (ORR) |
50.5(43.4, 57.6) |
36.2(29.5, 42.9) |
|
임상적 이점 비율(CBR) |
81.8(76.3, 87.2) |
63.8(57.1, 70.5) |
|
a전체반응률(ORR, Overall response rate) = 완전 관해 및 부분 관해를 보인 환자의 비율 b임상적 이점 비율(CBR, clinical benefit rate) = 완전 관해를 보인 환자+ 부분 관해(+ 안정 병변 혹은 불완전반응/질환 무진행24주 이상) 보인 환자의 비율 | ||
키스칼리+ NSAI 병용군에서의 결과는 나이, 이전의 보조요법 또는 신 보조요법의 화학치료 및 호르몬 치료, 간 및/또는 폐의 연관성, 뼈로만의 전이의 환자 하위 그룹에서 일관되었다.
전체 생존률에 대한 업데이트 된 결과는(2018년11월30일, cut off) [표18]에요약되어있다.
이차 전체 생존률 분석에서, 주요 이차 평가 변수에 도달하였으며 통계학적으로 현저하게 향상된 전체 생존률을 보였다.
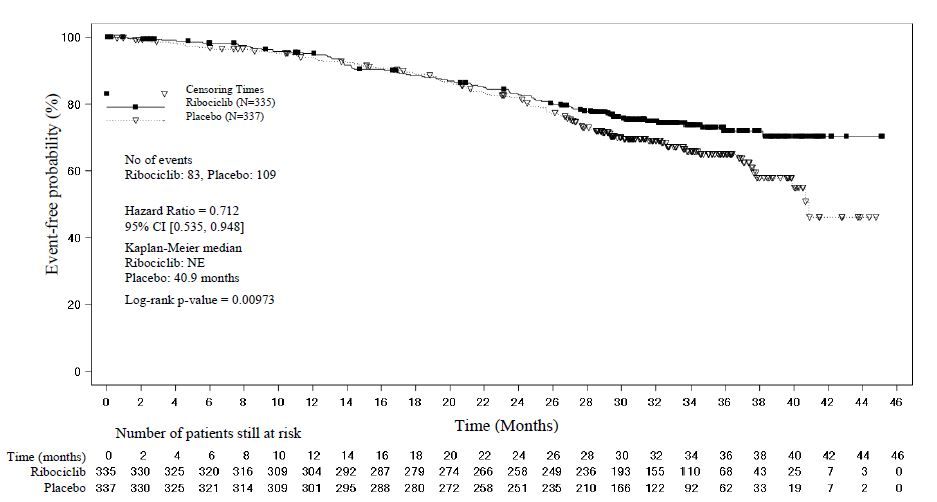
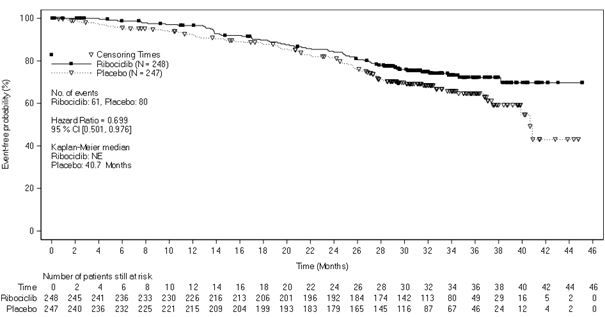
[표18]. MONALEESA ‑7 유효성 결과(전체 생존률) (2018년11월30일cut off)
|
전체 생존률, 전체 시험 대상자군 |
이 약600mg N=335 |
위약 N=337 |
|
사건n(%) |
83(24.8) |
109(32.3) |
|
전체 생존률 중앙값(개월,95% CI) |
NE(NE, NE) |
40.9(37.8, NE) |
|
위험비(95% CI) |
0.712(0.535, 0.948) | |
|
p 값 |
0.00973 | |
|
전체 생존률, NSAI 하위군 |
이 약600mg N=248 |
위약 N=247 |
|
사건n(%) |
61(24.6) |
80(32.4) |
|
전체 생존률 중앙값(개월,95% CI) |
NE(NE, NE) |
40.7(37.4, NE) |
|
위험비(95% CI) |
0.699(0.501, 0.976) | |
|
p-값은 간 및/또는 폐 전이의 유무, 진행성 질환에 대한 이전 화학요법 치료, IRT(interactive response technology) 에 따른 내분비요법 약제에 대한 단측 층화 로그 순위 검정을 통해 얻어진 값이다. NE = Not estimable | ||
[그림6]. MONALEESA ‑7 : 전체 생존률에 대한 카플란 ‑마이어 그래프(모든 분석 대상자군, 2018년11월30일cut ‑off)
[그림7]. MONALEESA ‑7 : 전체 생존률에 대한 카플란 ‑마이어 그래프(NSAI, 2018년11월30일cut off)
전체 연구 환자군에서 다음 차수의 치료로 진행 또는 사망까지의 시간(PFS2)은 이 약 투여군에서 위약 투여군보다 길었다(HR: 0.692 (95% CI: 0.548, 0.875)). PFS2 중앙값은 위약군에서32.3 개월(95% CI: 27.6, 38.3)이며, 이 약 투약군에서는 도달하지 않았다. (95% CI: 39.4, NE). NSAI 투여 하위군에서도 유사한 결과를 얻었으며(HR: 0.660(95% CI: 0.503, 0.868) PFS2 중앙값은 위약 투여군에서32.3 개월(95% CI: 26.9, 38.3) 이며 이 약 투여군에서는 도달하지 않았다. (95% CI: 39.4, NE)
⓸ MONALEESA ‑3: 풀베스트란트와 이 약의 병용
(호르몬 수용체(HR) ‑양성 및 사람상피세포 성장인자수용체2(HER2) ‑음성인 진행성 또는 전이성 유방암을 가진 폐경 후 여성에서의 일차 내분비 요법 또는 질환이 진행된 여성에서의 내분비 요법)
임상 시험MONALEESA ‑3은 이전에 내분비 요법을 받은 적이 없거나 일차 내분비 요법만 받은 호르몬 수용체 양성, HER ‑2 음성 진행성 유방암을 가진 폐경기 여성을 대상으로 리보시클립과 풀베스트란트를 병용투여하는 무작위배정, 이중 맹검, 위약 대조 임상 시험이다.
총726명의 환자가2:1의 비율로 무작위 배정되어 이 약600mg+풀베스트란트(n=484)를, 위약+풀베스트란트(n=242)를 투여 받았고, 간 및/또는 폐 전이의 유무(전이 있음(n=351(48.3%)) 전이 없음(n=375(51.7%)), 진행성 또는 전이성 질환에 대한 이전 내분비 요법 치료(1차 요법(n=354(48.8%), 2차 요법(n=372 (51.2%))에 따라 층화되었다. 진행성 유방암의1차 요법 환자군은 이전 내분비 요법 치료를 받은 적이 없는 신생 유방암 환자 또는(신)보조요법의 내분비요법을 마친 뒤12개월 이후에 재발한 환자들을 포함하였다. 2차 요법 환자는 보조요법 치료 중 질병이 재발하였거나, 내분비 보조요법을 마친 이후12개월 이내에 질환이 재발한 경우 그리고 일차 내분비 요법으로 진행한 경우를 포함한다. 이 약은21일간 하루600mg 경구 투여 후7일간 휴약기를 가졌으며, 풀베스트란트는500mg을1, 15, 29일 그리고 이후 한 달에 한 번씩 근육 내 투여 받았다.
임상시험MONALEESA ‑3에 등록한 환자의 연령 중앙값은63세(범위: 31~89세)였다. 등록한 환자 중, 만75세 이상인13.8%를 포함하여46.7%의 환자는 만65세 이상이었다. 환자들은 주로 백인(85.3%), 동양인(8.7%), 흑인(0.7%)였다. 거의 모든 환자들(99.7%)의ECOG 수행상태는0점 또는1점이었다. 1차 및2차 요법 환자들은 이 시험에 등록하였다(이들 중19.1%는 신생 전이 질환). 보조요법 받는 환자의42.7%는 항암화학요법을 받은 반면 신보조요법에서는13.1% 만이 항암화학요법을 받았고, 임상 시험에 들어가기 전58.5%는 보조요법으로 내분비 요법을 받은 반면 신보조요법을 받는1.4%만이 내분비요법을 받았다. 21.2%의 환자는 뼈에만 전이되었고60.5%는 내장기관에까지 전이되었다. 인구통계학과 베이스라인 질병 특성은 임상 시험 군에서 모두 균형을 이루고 비교 가능하다.
일차 분석
이 시험의 일차 평가 변수는 고형암에서 반응 평가 기준(Response Evaluation Criteria in Sold Tumor, RECIST) 버전1.1을 통한361건의 무진행 생존기간을 관찰함으로서 도달하였다. (무작위 배정 환자군, 2017년11월3일cut ‑off). 일차PFS 분석 시점에서 추적기간의 중앙값은20.4개월이었다.
모든 분석 대상자군에서 일차 유효성 결과는 위 약+ 풀베스트란트 병용군 보다 이 약+ 풀베스트란트 병용군에서 무진행생존기간(PFS)가 통계학적으로 의미 있게 향상됨을 보였으며, (HR: 0.593; 95% CI: 0.480, 0.732; 단측 층화 로그 순위 검정p ‑값4.1 X 10 ‑7)이 약+ 풀베스트란트 병용 군에서 질병 진행 또는 사망의 상대 위험성이 대략41% 감소하였다. PFS 중앙값(95% CI) 은 이 약+ 풀베스트란트 병용군에서20.5 개월(18.5, 23.5), 위약+ 풀베스트란트 병용군에서12.8개월(10.9, 16.3) 이었다.
맹검된 독립적인 검토 위원회(BIRC, blinded independent review committee)에서40% 이미징 된 하위군에 대한 무작위 중앙 감사를 통해 일차 유효성 결과를 뒷받침 하였다.(위험비0.492 (95% CI, 0.345 ‑ 0.703)).
무진행 생존기간은 이차 전체 생존률 중간 분석 시점에서 업데이트 되었으며, 전체 분석군 및 하위군에 대한PFS 결과는 [표19] 및 [그림8]에요약되어있다.
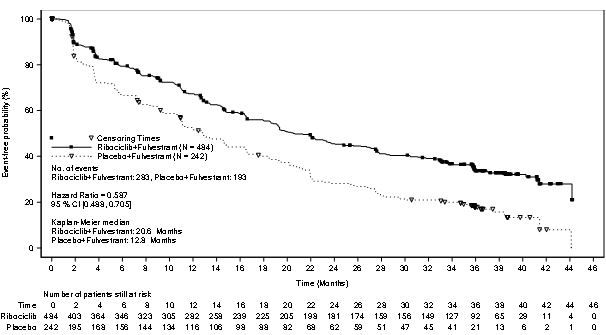
[표19]. MONALEESA ‑3 무진행생존기간(시험자평가, 2019년6월3일cut off)
|
|
이 약+풀베스트란트 N=484 |
위약+ 풀베스트란트 N=242 |
|
무진행 생존기간 | ||
|
사건n(%) |
283(58.5) |
193(79.8) |
|
중앙값(개월)(95% CI) |
20.6(18.6, 24.0) |
12.8(10.9, 16.3) |
|
위험비(95% CI) |
0.587 (0.488, 0.705) | |
|
1차 요법 단계1 |
이 약+풀베스트란트 N=237 |
위약+ 풀베스트란트 N=128 |
|
사건(n, %) |
112(47.3) |
95(74.2) |
|
무진행 생존기간 중앙값 (개월, 95% CI) |
33.6(27.1, 41.3) |
19.2(14.9, 23.6) |
|
위험비(95% CI) |
0.546(0.415, 0.718) | |
|
2차 요법 단계 또는 조기 재발2 |
이 약+풀베스트란트 N=237 |
위약+ 풀베스트란트 N=109 |
|
사건(n, %) |
167(70.5) |
95(87.2) |
|
무진행 생존기간 중앙값 (개월, 95% CI) |
14.6(12.5, 18.6) |
9.1(5.8, 11.0) |
|
위험비(95% CI) |
0.571(0.443, 0.737) | |
|
CI = 신뢰구간(confidence interval) 11차 요법 단계: 새로 진단된(신생) 진행성의 유방암 또는(신) 보조요법의 내분비 요법 완료 후12개월 이후의 재발이며 진행성 또는 전이성 질환에 대한 치료받은 적 없음 2보조요법 중 또는(신)보조요법의 내분비 요법 종료 이후12개월 이내의 재발(조기재발), 진행성 질환에 대한 일차의 내분비요법 이후 질환의 진행 | ||
[그림8]. MONALEESA ‑3 : 무진행 생존기간에 대한 카플란 ‑마이어 그래프(시험자 평가, 2019년6월3일cut ‑off)
[표20]. MONALEESA ‑3 유효성 결과(ORR, CBR) (시험자 평가, 2017년11월3일cut ‑off)
|
|
이 약+ 풀베스트란트 (%, 95% CI) |
위약+ 풀베스트란트 (%, 95% CI) |
|
모든 분석 대상자군 |
N=484 |
N=242 |
|
전체 반응률(ORR)a |
32.4(28.3, 36.6) |
21.5(16.3, 26.7) |
|
임상적 이점 비율(CBR)b |
70.2(66.2, 74.3) |
62.8(56.7, 68.9) |
|
측정 가능한 질병을 가진 환자 |
N=379 |
N=181 |
|
전체 반응률(ORR)a |
40.9(35.9, 45.8) |
28.7(22.1, 35.3) |
|
임상적 이점 비율(CBR)b |
69.4(64.8, 74.0) |
59.7(52.5, 66.8) |
|
a전체반응률(ORR, Overall response rate) = 완전 관해 및 부분 관해를 보인 환자의 비율 b임상적 이점 비율(CBR, clinical benefit rate) = 완전 관해를 보인 환자+ 부분 관해(+ 안정 병변 혹은 비완전관해/질환 무진행≥ 24 주 | ||
전 ‑특성화된 이 약+ 풀베스트란트 투여 환자군 전 ‑분석에 근거한 위험비는 나이, 이전의 보조요법 또는 신 보조요법의 화학치료 및 호르몬 치료, 간 및/또는 폐의 연관성, 뼈로만의 전이의 환자 하위 그룹에서 일정한 결과를 보였다.
전체 생존률 분석
이차 전체 생존률 분석에서, 이 연구는 이차평가변수에 도달하였으며, 전체 생존률에서 통계학적으로 유의미한 향상을 보였다.
[표21]. MONALEESA ‑3: 유효성 결과(전체 생존률, 2019년6월3일cut off)
|
|
이 약+풀베스트란트 |
위약+ 풀베스트란트 | |
|
전체시험자수 |
N=484 |
N=242 | |
|
사건(n, %) |
167(34.5) |
108(44.6) | |
|
전체 생존률 중앙값 (개월, 95% CI) |
NE(42.5, NE) |
40(37, NE) | |
|
위험비(95% CI)1 |
0.724(0.568, 0.924) | ||
|
p 값2 |
0.00455 | ||
|
1차 요법 단계 |
|
| |
|
전체시험자수 |
N=237 |
N=128 | |
|
사건(n, %) |
63(26.6) |
47(36.7) | |
|
위험비(95% CI)3 |
0.700(0.479, 1.021) | ||
|
2차 요법 단계 또는 조기 재발2 |
|
| |
|
전체시험자수 |
N=237 |
N=109 | |
|
사건(n, %) |
102(43.0) |
60(55.0) | |
|
위험비(95% CI) |
0.703(0.530, 1.004) | ||
|
NE = Not, Estimable 측정할 수 없음 1 위험비는CoX PH 모델에 근거하며, 간 및/또는 폐 전이, IRT에 따른 이전의 내분비 요법에 따라 층화되었다. 2 단측p 값은 폐 및/또는 간 전이, IRT 에 따른 이전 내분비 요법에 따라 층화된 로그 순위 검정에 근거한다. P-값은 단측 이며 전체적인 유의도가0.025인Lan-DeMets (O’brien fleming) alpha spending function로 결정된 한계치0.01129와 비교되었다. 3 위험비는 층화되지 않은CoX PH 모델에 근거하였다. | |||
[그림9]. MONALEESA ‑3 전체 생존률에 대한 카플란 마이어 그래프(2019년6월3일cut off)
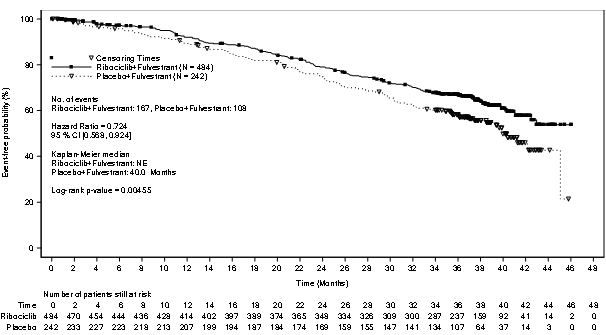
전체 연구 환자군에서 다음 차수의 치료로 진행 또는 사망까지의 시간(PFS2)이 이 약 투여군과 위약 투여군에서 비교되었으며, 이 약 투여군에서 더 길었다. (위험비HR: 0.670(95% CI:0.542, 0.830)). PFS2의 중앙값은 이 약 투여군에서39.8개월(95% CI:32.5, NE) 이며, 위약 투여군에서29.4 개월(95% CI:24.1, 33.1) 이었다.

